Пороки клапанов сердца
Пороки клапанов сердца характеризуются повреждением или дефектом одного из четырех сердечных клапанов: митрального, аортального, трикуспидального или легочного.
Митральный и трикуспидальный клапаны контролируют поток крови между предсердиями и желудочками (верхняя и нижняя камеры сердца).
Легочный клапан управляет потоком крови от сердца к легким, а аортальный клапан регулирует кровоток между сердцем и аортой, и, следовательно, кровеносные сосуды к остальному телу.
При нормальной функции клапанов сердца кровь течет с должной силой в нужном направлении в нужное время.
Чаще всего встречаются пороки митрального и аортального клапанов.
Степени тяжести порока сердца бывают разные. В легких случаях симптомы могут отсутствовать, а в запущенных случаях порок может привести к застойной сердечной недостаточности и другим осложнениям. Лечение зависит от степени заболевания.
Причины пороков клапанов сердца
Причин много. Некоторые из них присутствуют при рождении (врожденные), а другие могут быть приобретены в более позднем возрасте:
- старение клапанов: ткань сердечного клапана может деградировать с возрастом на фоне атеросклероза, потерять эластичность и стать твердой;
- ревматизм;
- бактериальный эндокардит;
- высокое кровяное давление;
- инфаркт миокарда;
- опухоли сердца
- системные заболевания (ревматоидный артрит, системная красная волчанка, сифилис);
- лучевая терапия, применяемая для лечения рака.
Симптомы, которые могут появляться по причине порока клапанов сердца
Симптомы при заболеваниях сердца могут возникать внезапно, в зависимости от того, насколько быстро болезнь развивается. При медленном течении заболевания сердце может приспособиться, и вы можете не заметить начало каких-либо симптомов. Важно понимать, что тяжесть симптомов неравнозначно тяжелому пороку клапана сердца и наоборот, симптомы могут вообще отсутствовать при тяжелых пороках.
Симптомы заболевания сердца включают:
- Одышка при физических нагрузках, быстрая утомляемость
- Отеки конечностей, быстрое увеличение веса за счет скопления жидкости
- Сердцебиение или перебои в работе сердца
- Боль в груди
- Головокружение или обморок
- Лихорадка (при инфицировании клапана)
- Для выявления и лечения заболеваний клапанов сердца важна правильная и своевременная диагностика.
- Диагностика пороков
- Определить порок клапанов сердца можно прислушиваясь к характерным звукам, известным как шумы в сердце.
- Для полной диагностики порока нужно пройти одно или несколько из следующих исследований:
- Электрокардиограмма (ЭКГ) показывает электрическую активность сердца, регулярность сердечных сокращений, утолщение (гипертрофию) и повреждение сердечной мышцы от ишемической болезни сердца.
- Рентген грудной клетки показывает увеличение камер сердца вследствие нарушения функции клапанов сердца.
- Эхокардиограмма (ЭхоКГ) – золотой стандарт в современной диагностике. На ЭхоКГ звуковые волны, отражающиеся от сердца, записываются и преобразуются в изображения. Снимки могут выявить аномальный размер, форму и движение сердца, дисфункцию клапанов.
- Коронарография, которая представляет собой введение катетера в сердце для оценки состояния сосудов, кровоснабжающих сердце.
Пороки митрального клапана
Встречаются три типа нарушения функции митрального клапана:
- Пролапс митрального клапана — это когда обе створки клапана увеличены и выпячиваются, что мешает им равномерно закрываться.
- Недостаточность — это когда створки клапана не закрываются плотно, поэтому кровь просачивается обратно в левое предсердие сердца. Недостаточность может произойти внезапно (острая) или, что чаще, постепенно со временем (хроническая). Острая недостаточность митрального клапана часто вызвана повреждением сердца, например, инфарктом или инфекционным эндокардитом.
Существует множество причин, по которым может развиться хроническая недостаточность митрального клапана. Симптомы включают усталость, одышку при физической нагрузке и в положении лежа, перебои в работе сердца.
-
Стеноз — створки митрального клапана утолщаются, становятся жесткими и даже могут срастаться. Из-за этого происходит сужение отверстия клапана. Среди взрослых пациентов стеноз чаще встречается у женщин, в основном причиной является ревматизм.
Симптомы включают одышку при физической нагрузке, отеки нижних конечностей, сердечные аритмии. У некоторых пациентов в левом предсердии образуются сгустки (тромбы).
Эти сгустки могут перемещаться по кровеносным сосудам и повреждать мозг, селезенку или почки.
Пороки аортального клапана
Недостаточность аортального клапана возникает, когда створки клапана не смыкаются и кровь возвращается обратно в левый желудочек сердца.
У пациента может быть значительная аортальная недостаточность в течение долгих лет без развития выраженных симптомов.
Признаки болезни проявляются как сердцебиение, одышка при физической нагрузке или в положении лежа (может быть внезапная сильная одышка посреди ночи), боли в груди.
Стеноз аортального клапана чаще поражает мужчин, чем женщин.
Это состояние, когда створки утолщаются, становятся жесткими и сливаются вместе, что сужает клапан и препятствует нормальному оттоку крови из сердца в аорту и остальную часть тела.
Стеноз аортального клапана обычно не вызывает симптомов до тех пор, пока отверстие клапана не сузится примерно до одной трети от нормы. Симптомы включают одышку при нагрузке, боль в груди и обмороки.
- Недостаточность трехстворчатого клапана
- Это порок сердца, характеризующийся неполным смыканием створок трехстворчатого клапана и обратным током крови из правого желудочка в правое предсердие.
- Причиной поражения трехстворчатого клапана, как и других клапанов сердца, может быть ревматизм, миксоматоз, инфекционный эндокардит или травма грудной клетки.
- Недостаточность трехстворчатого клапана также может быть не связана с поражением самого клапана, а возникнуть вследствие длительного течения митрального и аортального пороков, при отсутствии или неправильном их лечении.
- Лечение пороков клапанов сердца
- Лечение пороков клапанов сердца будет зависеть от типа и тяжести состояния и может включать медикаментозное лечение или операцию.
Если порок сердца значимый и лекарства не помогают, выполняются операции по восстановлению или замене клапана сердца.
В настоящее время хирургия клапанов сердца стремится к выполнению клапансохраняющих операций.
Благодаря усовершенствованию техники реконструктивных операций, возможно восстановить клапан даже при инфекционном эндокардите. В других случаях производится замена клапана искусственным протезом.
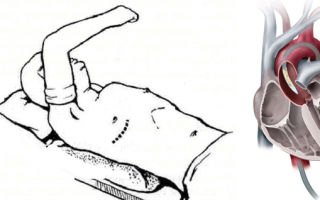
Искусственные клапаны сердца
Искусственные клапаны сердца со времен изобретения значительно усовершенствовались, и в настоящее время на вооружении кардиохирургов имеются протезы, которые могут максимально приближенно выполнять функцию собственного клапана.
В зависимости от состава искусственные клапаны сердца бывают механическим и биологическим. Механические клапаны изготавливают полностью из синтетических материалов, их достоинства — прочность, долговечность и износостойкость. Недостаток – необходимость пожизненного приема антикоагулянтов (препараты для разжижения крови), для предотвращения образования тромбов.
Искусственные протезы сердца
Биологические клапаны изготавливаются из тканей сердца животных, и обработаны специальными растворами, повышающими износостойкость и препятствующими иммунному отторжению после имплантации.
Преимущества биологических протезов – отсутствие необходимости пожизненного приема антикоагулянов. Недостаток – быстрый износ, ограничение в возрасте пациента.
Биологические протезы рекомендованы пациентам старше 70 лет, их срок работы около 10-15 лет.
- Операция на сердце
- В большинстве случаев на операции хирург чтобы достичь сердца, делает разрез посередине грудины, использует аппарат искусственного кровообращения для циркуляции крови по телу во время операции, останавливает и открывает сердце, чтобы добраться до пораженного клапана, затем восстанавливает или заменяет клапан.
- Так же выполняются операции на клапанах сердца через небольшой разрез на правой стороне грудной клетки с использованием видеоподдержки.
Пациентам с аортальным стенозом возможно выполнение протезирования аортального клапана биологическим протезом через бедренную артерию или верхушку сердца – без разреза грудины и остановки сердца. Проводят такую операцию возрастным пациентам с высоким риском стандартной открытой операции на сердце. В таком случае имплантируют только биологические протезы.
После операции на сердце
Всемирная организация здравоохранения (ВОЗ) определила здоровье как не только отсутствие болезней и недугов, но также наличие физического, психического и социального благополучия. Целью операции на сердце является не только продление жизни, но и улучшение функциональной мобильности и качества жизни.
Операция на открытом сердце – серьезное вмешательство, после которой нужно время для полного восстановления. Оно зависит от возраста и общего состояния здоровья человека, а также от сложности операции.
При своевременном обращении за хирургической помощью возможно избежать послеоперационных осложнений и пройти короткий путь восстановления практически в 100 % случаях.
В течение первых двух недель пациент чувствует усталость и слабость, общее состояние постепенно восстанавливается в течение следующего месяца. На этот период нужно ограничить тяжелые физические нагрузки, отказаться от спорта.
Нужно выходить из дома не реже 2 раз в день для небольшой прогулки и стараться каждый день немного увеличивать нагрузки.
Грудина полностью заживает в течение двух месяцев, после чего можно будет вернуться к обычным бытовым нагрузкам.
Для многих пациентов возвращение домой после операции на сердце большое облегчение, для некоторых это может быть довольно пугающим. Выполняйте рекомендации лечащего врача, вовремя принимайте назначенные препараты, от этого зависит длительность и качество Вашей жизни.
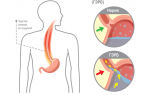
Пролапс митрального клапана (ПМК) – причины, симптомы и лечение
Пролапс митрального клапана (ПМК) – это сердечная аномалия, одна из самых распространённых патологий сердца. При наличии данной патологии створки митрального клапана провисают/выпячиваются в полость предсердия, это происходит в момент сокращения левого желудочка сердца. В результате такой сердечной аномалии может происходить регургитация, когда часть крови возвращается в левое предсердие. Данная патология относиться к доброкачественным (в отличие от пороков сердца, например), но также может иметь серьезные неприятные последствия, к сожалению. Регургитация тяжелой степени может стать причиной инвалидности. В одних случаях пролапс митрального клапана требует серьезного лечение (медикаментозного или даже хирургического), в других – врачи ограничиваются лишь наблюдением за пациентом, человек должен регулярно проходить обследования и следить за своим образом жизни.
Очень часто человек не знает о том, что у него есть ПМК и обнаруживается данная аномалия в процессе медицинского обследования по какому-то другому вопросу, так как симптомы данного заболевания часто носят не специфический характер: головная боль, утомляемость, головокружения, кардиальные боли. Поэтому очень важно при наличии проблем со здоровьем, даже если это легкая утомляемость или недомогание, которые при этом носит длительный характер, не откладывать визит к врачу.
Пролапс митрального клапана: причины
Существуют 2 вида пролапса митрального клапана – первичный и вторичный, согласно происхождению патологии.
Причинами первичного пролапса митрального клапана являются генетические дефекты. Данный вопрос еще не до конца изучен, но есть свидетельства того, что ПМК – заболевание, которое передается по наследству.
Кроме того, повлиять на возможность развития у человека ПМК могут отрицательные факторы, оказывающие негативное действие на плод еще в утробе матери.
К таким факторам относятся перенесенные вирусные заболевания матери в процессе беременности, гестоз, плохое экологическое окружение.
Первичный ПМК подразделяется на:
- Пролапс митрального клапана как самостоятельная болезнь.
- Пролапс митрального клапана как проявление нарушения развития соединительной ткани (дисплазия соединительной ткани, синдром Марфана, синдром Элерса-Данло). В данном случае патология, помимо ПМК, может проявляться гипермобильностью суставов, искривлениями позвоночника, деформацией грудной клетки, у человека часто происходят вывихи и подвывихи суставов, и другими симптомами.
Причинами вторичного ПМК являются другие заболевания, именно на их фоне и возникает вторичный пролапс сердца:
- врожденные пороки сердца;
- приобретенные пороки сердца;
- ИШБ (ишемическая болезнь сердца);
- миокардиты;
- ревматическая болезнь сердца;
- кардиомиопатия.
Патогенез ПМК.
Митральный клапан разделяет полости желудочка сердца и его левого предсердия.
Когда митральный клапан находится в норме, то его створки «отклонены» вниз в момент расслабление миокарда и наполнения полостей сердца кровью и наоборот – створки «подняты» вверх в момент сокращения предсердий, левое предсердно-желудочковое отверстие закрыты.
При ПМК клапан работает неверно: в фазу сокращения предсердий створки клапана «прогибаются» в полость левого предсердия, а так быть не должно. Ведь по этой причине атриовентрикулярное отверстие полностью либо частично перекрывается и возникает обратное движение крови из левого желудочка в левое предсердие (митральная регургитация).
В случае наличия у человека пролапса митрального клапана может уменьшаться способность сердечной мышцы к сокращению, что в свою очередь может привести к возникновению недостаточность кровообращения; также может отмечаться наличие артериальной гипотензии, пограничной легочной гипертензии, нарушение обмена веществ и дисфункция вегетативной нервной системы.
Пролапс митрального клапана: симптомы.
Пролапс митрального клапана может протекать как с ярко выраженными симптомами, так и абсолютно «тихо», не давая о себе знать. Необходимо обращать внимание на сигналы организма, в том числе на «простые» головную боль, усталость, не списывать их, например, на стресс, не пропускать их мимо и находить причину.
У детей и подростков довольно часто болезнь протекает именно бессимптомно или сопровождается лишь незначительным дискомфортном в области грудной клетки. Также при наличии первичного ПМК у детей обнаруживаются болезни, которые свидетельствуют о нарушении развития соединительной ткани:
- сколиоз;
- деформация грудной клетки;
- гипермобильность суставов;
- дисплазия тазобедренных суставов;
- плоскостопие;
- грыжи (пупочные, паховые);
- нефроптоз и др.
Вместе с тем можно выделить характерные для пролапса митрального клапана симптомы:
- пониженное артериальное давление, как следствие – головокружения;
- частое сердцебиение;
- чувство, что сердце работает «с перебоями»;
- предобморочное состояние, которое проявляется, в том числе, чувством тошноты, мушками перед глазами;
- давящая или сжимающая (иногда колющая) боль за грудиной или в грудной клетке (ее левой части) – может появляться как от физической нагрузки, стресса, так и без определенной причины;
- ощущение постоянной усталости, проблемы с дыханием (затруднено), отеки ног, боль в правом боку (причина боли – увеличение печени).
Вторичный ПМК дополняется также симптомами и основной болезни пациента – синдромом Марфана, пороками сердца (врожденными), ревмокардитом.
Степени пролапса митрального клапана (классификация).
Пролапс митрального клапана классифицируется на первичный и вторичный (согласного происхождению болезни), на пролапс передней, задней и обеих створок клапана (согласно локализации.
Согласно выраженности определяются 3 степени ПМК
- I степень — створки клапана «выпадают» на 3–6 мм., смыкание створок митрального клапана — полное (по этой причине ПМК I степени может проходить бессимптомно).
- II степень — створки клапана «выпадают» на 7–9 мм., створки митрального клапана смыкаются неплотно, присутствует обратный заброс крови из желудочка в предсердие (ретургитация).
- III степень — створки клапана «выпадают» свыше 9 мм.
Кроме того, врачи отдельно классифицируют степень выраженности митральной регургитации (обратное движение крови из левого желудочка в левое предсердие):
- I степень — обратное движение крови случается на уровне створок;
- II степень — волна регургитации доходит до середины левого предсердия;
- III степень — волна регургитации проходит более половины предсердия;
- IV степень — волна регургитации доходит до противоположного конца предсердия.
Диагностика ПМК.
Пролапс митрального клапана в подавляющем большинстве случаев выявляется с помощью неинвазивных обследований, окончательный диагноз устанавливается с помощью эхокардиография, также используется ряд других исследований:
- Опрос больного на жалобы, сбор анамнеза.
- Общий анализ крови.
- Биохимический анализ крови.
- Аускультативное обследование. Врач выслушивает сердце с помощью стетоскопа и может уловить определенный, характерный для болезни щелчок и/или систолический шум над верхушкой сердца – в положении пациента стоя, в положении сидя или лежа эти звуки уменьшаются.
- Электрокардиография (ЭКГ). На ней врач может увидеть неспецифические изменения сегмента ST и зубца Т в отведениях III и aVF, а также «синдром укороченного PQ») наджелудочковые тахикардии.
- Эхокардиография (УЗИ сердца). Здесь врач может обнаружить такие признаки болезни, как провисание створок митрального клапана (задней или сразу обеих) в полость левого предсердия в середине систолы, в позднюю систолу или во всю систолу. Эхокардиография – это одно из самых важных обследований в диагностике ПМК у пациента.
- Рентгенограмма грудной клетки. На ней могут быть признаки сглаженного лордоза (но также может быть и в норме).
- МРТ (грудной клетки).
После всех исследований кардиолог назначает необходимое лечение.
Пролапс митрального клапана: лечение.
Лечение ПМК может назначить только кардиолог, требуется оно в том случае, если человек имеет боли в сердце и присутствует нарушение сердечного ритма.
Факторы, влияющие на необходимость лечения:
- степень «выпадения» створки клапана;
- наличие ретургитации;
- наличие осложнений.
При ПМК I степени и отсутствии у человека каких-либо осложнений, боли, неприятных ощущений – лечение не требуется. Однако необходим отказ от курения, потребления кофе в больших количествах; важно постоянно посещать врача и обследоваться.
При ПМК I степени с регургитацией I степени и ПМК II и III степени (особенно если выявлены нарушения сердечного ритма и/или недостаточность кровообращения) – назначается медикаментозная терапия. Кроме того, в сложных случаях назначается хирургическое лечение.
Также для пациентов с диагнозом ПМК рекомендуется:
- отказаться от излишних физических нагрузок, избегать переутомления; физические нагрузки должны быть умеренные;
- отказаться от курения, алкоголя, не пить кофе и крепкий чай;
- соблюдать режим сна;
- сбалансированно питаться.
Может ли исчезнуть пролапс митрального клапана?
Да, существует физиологический пролапс митрального клапана: он появляется из-за «незрелости» самого клапана и подклапанного аппарата. Физиологический пролапс является безопасный, к возрасту 18-20 лет сердце «созревает» и клапан работает так же, как у здорового человека.
Пролапс митрального клапана: осложнения:
- нарушения сердечного ритма (одно из самых распространенных осложнений);
- ишемический инсульт;
- воспаление миокарда;
- изменения сосудов с нарушением кровообращения в мозгу.
ПМК: прогноз и профилактика.
В целом прогноз по ПМК достаточно благоприятный, главное – постоянное клиническое наблюдение за больным для определения степени недостаточности митрального клапана.
Часто пролапс митрального клапана не влияет на физическую активность (среди людей с ПМК есть профессиональные спортсмены, танцоры и т.д.
), однако есть признаки, выявление которых является «тревожным звоночком» и приводят к запрету на активные анаэробные нагрузки:
- синдром удлинённого QT;
- синдром Марфана;
- потеря сознания в анамнезе (без причины);
- дисфункция левого желудочка;
- приступы предсердной тахикардии;
- серьёзная митральная недостаточность.
Всем пациентам с ПМК необходимо следить за состоянием своего здоровья, избегать частых инфекции и обязательно заниматься их лечением при возникновении.
Профилактикой ПМК является отсутствие неблагоприятного воздействия на здоровье беременной женщины и развивающийся в утробе плод, своевременная диагностика и лечение заболеваний, которые повреждают клапанный аппарат сердца.
Ни в коем случае не пренебрегайте диагнозом ПМК и всегда строго следуйте рекомендациям врача!
Фиброз сердца и печени: составляющие одного уравнения
ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава РФ, Клиника пропедевтики внутренних болезней им. В.Х. Василенко, 119881 Москва, ул. Погодинская, д.1, стр.1
Фиброз миокарда играет ключевую роль в патогенезе сердечно-сосудистых заболеваний. При хронической перегрузке давлением в сердце происходит активация синтеза коллагена, что приводит к его избыточному накоплению, фиброзу и гипертрофии миокарда.
Повреждению миокарда часто сопутствует поражение печени. Эти два процесса тесно взаимосвязаны. Одним из связующих звеньев этой цепи служит активация ренин-ангиотензин-альдостероновой системы (РААС).
Существует внушительная доказательная база в отношении препаратов, блокирующих РААС, и тем самым разрывающих порочный замкнутый круг сердечно-сосудистого континуума.
Процессы фиброгенеза неспецифичны и перспектива применения средств, влияющих на активность РААС, может быть полезной для предотвращения фиброза не только в сердце и печени, но и в других органах.
Фиброзом называют уплотнение соединительной ткани в различных органах, которое сопровождается появлением рубцовых изменений. Эти рубцовые изменения возникают, как правило, на месте хронического воспаления: атрофии или дистрофии. В контексте фиброза основными «действующими лицами» являются компоненты внеклеточного матрикса — гликопротеины, протеогликаны и гиалуроновая кислота.
В пораженных тканях наблюдается чрезмерное накопление фибробластов и белков внеклеточного матрикса, включая коллаген, который служит основной структурной единицей фиброза. Коллаген — превалирующий гликопротеин внеклеточного матрикса.
Это вещество представляет собой фибриллярный белок, который составляет основу соединительной ткани организма и обеспечивает ее прочность и эластичность. Пучки коллагена имеют форму тройной спирали, которые сшиваются вместе и образуют очень прочные коллагеновые фибриллы.
Их прочность сравнима с прочностью стали [1].
Однако фиброз — не просто преобладание синтеза коллагена над его распадом. Это еще и процесс «структурирования» коллагена. Только структурированный коллаген имеет значение в развитии фиброза.
Существуют 2 основных типа фиброза: реактивный и репаративный.
Чаще всего мы встречаемся с реактивным типом, который наиболее характерен для большинства больных артериальной гипертонией (АГ), страдающих абдоминальным ожирением, с длительно текущей и плохо леченной АГ.
В качестве отсроченных последствий инфаркта миокарда можно рассматривать формирование на месте некроза рубца. Этот процесс является ярким примером репаративного фиброза. Атрофия и дистрофия ткани лежат в его основе. В этом случае пласты здоровых кардиомиоцитов чередуются с участками соединительной ткани [2].
Прогрессирование фиброза зависит, с одной стороны, от времени, а с другой — от микровоспалительной реакции, которая возникает в результате встречи с различными факторами (облучение, травма, инфекционно-аллергические факторы и др.). Выраженность микровоспалительной реакции определяет степень фиброза [3].
Конечно, в качестве одной из основополагающих причин фиброза нельзя не упомянуть значительную роль генетических структур, ответственных за синтез регуляторных белков. Эти белки участвуют в процессе фиброгенеза и могут приводить к ускорению или замедлению соответствующего процесса.
Главным механизмом в развитии фиброза служит активация ренин-ангиотензин-альдостероновой системы (РААС). Эта система контролирует тонус сосудов и гомеостаз натрия и воды. Основной действующий компонент РААС — ангиотензин-II (АТII), который представляет собой октапептид (состоит из 8 аминокислот).
АТII образуется путем отщепления от неактивного предшественника ангиотензина-I (АТI) двух последних (C-концевых) аминокислот под воздействием ангиотензинпревращающего фермента (АПФ). АТII обладает высокой функциональной активностью, в первую очередь, в отношении сердечно-сосудистой системы, почек и надпочечников. Этот белок играет основную роль в развитии фиброза.
Согласно данным экспериментальных и клинических исследований, ATII рассматривается как медиатор воспаления, который непосредственно активирует ремоделирование сердца. Кроме того, ATII отрицательно влияет на функцию эндотелия и стимулирует секрецию цитокинов и хемокинов. Но одним из наиболее отрицательных эффектов ATII в контексте фиброза служит его влияние на синтез коллагена.
При этом ATII наравне с альдостероном снижает деградацию коллагена, что приводит к его выраженной аккумуляции.
Итак, конечным результатом действия РААС является увеличение объема циркулирующей крови и повышение системного артериального давления (АД). Общие представления о РААС остались неизменными, однако появилась масса новых сведений.
Обнаружено, что РААС не является исключительно циркуляторной системой, и в тканях различных органах, в частности, сердце, печени, поджелудочной железе, существует ее автономный аналог.
В этих органах самостоятельно синтезируются отдельные фрагменты ангиотензина, которые участвуют в регуляции роста, апоптоза клеток, процессах воспаления и фиброгенеза.
Механизмы развития фиброза разных органов во многом схожи, но, учитывая особую интимную общность патогенетических реакций, приводящих к развитию фиброза сердца и печени, следует связать во…
Драпкина О.М., Драпкина Ю.С.
Фиброз миокарда: современные аспекты проблемы
- ГКМП — гипертрофическая кардиомиопатия
- ДКМП — дилатационная кардиомиопатия
- ИБС — ишемическая болезнь сердца
- ЛП — левое предсердие
- ММП-1 — матриксная металлопротеиназа-1
- МРТ — магнитно-резонансная томография
- ОФК — объемная фракция коллагена
- СН — сердечная недостаточность
- ССЗ — сердечно-сосудистые заболевания
- FGF — фактор роста фибробластов
- PICP — С-концевой пропептид проколлагена I типа
- PIIINP — N-концевой пропептид проколлагена III типа
- TGF-1β — трансформирующий 1β-фактор роста
На протяжении последних 40 лет сердечно-сосудистые заболевания (ССЗ) занимают лидирующие позиции среди причин общей смертности в нашей стране и во всем мире [1, 2]. Несмотря на некоторое снижение смертности от ССЗ в последние годы, по данным ВОЗ, в 2014 г. 1/3 смертельных исходов имела причиной ССЗ, а в России 60% умерших страдали болезнями системы кровообращения [3]. При этом основой прогрессирования большинства ССЗ, включая ишемическую болезнь сердца (ИБС), являются структурные изменения миокарда и сосудистой стенки, ключевым компонентом которых служит фиброз [4].
Фиброз миокарда характеризуется преобладанием синтеза коллагена I и III типов над его деградацией, что приводит к аккумуляции избытка волокон.
Выделяют два различных варианта аккумуляции коллагена при фиброзе миокарда: очаговый фиброз, при котором происходит замещение погибших кардиомиоцитов с формированием рубцов (заместительный фиброз), и диффузный фиброз, который развивается в интерстициальном или периваскулярном пространстве и, как правило, не сопровождается существенной потерей функционирующих клеток (реактивный фиброз) [5]. Оба варианта фиброза можно наблюдать после перенесенного инфаркта миокарда, однако диффузный фиброз наиболее характерен для хронических заболеваний сердца, в частности гипертонической болезни, гипертрофической кардиомиопатии (ГКМП), аортального стеноза [4]. Кроме различных инициирующих факторов развития диффузного и очагового фиброза, следует отметить, что в первом случае для фиброзной ткани характерен избыток коллагена I типа — волокон большого диаметра с большим количеством поперечных сшивок, по сравнению с коллагеном III типа — волокнами малого диаметра с минимальным количеством сшивок, который составляет основу заместительного фиброза [6]. Установлено, что в силу различных биофизических свойств коллагена этих типов — при небольшом увеличении соотношения количества коллагена I и III типов повышается жесткость миокарда.
Основными клетками фиброгенеза в миокарде признаны фибробласты, имеющие наибольшее сродство с интактной тканью, а также способные к появлению в результате эпителиально-мезенхимального перехода [7, 8] в ответ на повреждение, которое стимулирует экспрессию таких факторов, как эндотелин-1, трансформирующий 1β-фактор роста (TGF-1β) и ангиотензин II [9]. Большое значение для инициации фиброза отводится окислительному стрессу — конечному общему пути повреждения при различных патологических состояниях, часто наблюдающихся при заболеваниях сердца, легких и почек [10, 11]. Аккумуляция продуктов окисления и неспособность адаптироваться к стрессу, вызванному активными формами кислорода, могут привести к активации иммунной системы с развитием провоспалительного и профибротического состояния, вызывая функциональные и структурные изменения клеток [12]. При этом семейство факторов роста фибробластов (FGF) играет в этом процессе ключевую роль, способствуя гипертрофии и фиброзу миокарда через стимуляцию митогенактивируемых протеинкиназ и регуляцию активности α-Klotho (независимого от α-Klotho кальцинурин-/ядерного фактора активированных Т-клеток), который ингибирует фиброз миокарда, индуцированное TGF-β1, ангиотензином II и гиперфосфатемией [13], усиливая сопротивление окислительному стрессу и дисфункции эндотелия [14]. В экспериментальных моделях внутривенное введение α-Klotho сопровождалось снижением степени гипертрофии миокарда независимо от других факторов [15], тем не менее механизм независимой от α-Klotho сигнализации FGF в миокарде остается неясным [16], а вопрос о возможности модулирования этой сложной системы в целях улучшения исходов ССЗ пока не имеет ответа.
Доказано, что количественные и качественные характеристики фиброза миокарда ответственны за снижение его эластических свойств с развитием диастолической дисфункции [17], ухудшением сократимости с формированием систолической дисфункции [18], развитием нарушений ритма сердца [19] и ухудшением коронарного кровотока [20] у пациентов с сердечной недостаточностью (СН) различной этиологии.
Проаритмические эффекты фиброза миокарда, особенно межжелудочкой перегородки, находят объяснение в существенном нарушении атриовентрикулярного проведения [21], а также клеточной неоднородности — различных электрофизиологических свойствах кардиомиоцитов и фибробластов [22].
Установлены статистически значимые корреляции между фиброзом миокарда и аритмическими осложнениями, включая внезапную сердечную смерть [23].
Так, 3% увеличение внеклеточного объема соединительной ткани в миокарде по данным магнитно-резонансной томографии (МРТ) ассоциировано с 50% увеличением риска развития сердечно-сосудистых осложнений [24].
Представляют интерес данные об ассоциации фиброза предсердий (особенно левого предсердия — ЛП) с развитием их фибрилляции и значимым увеличением концентрации предсердных натрийуретических пептидов в крови [25].
Кроме того, продемонстрирована связь между увеличением объема эпикардиальной жировой ткани и обширностью фиброза предсердий у пациентов с фибрилляцией предсердий. Причем эта связь не зависела от объема ЛП, индекса массы тела и других факторов риска развития мерцательной аритмии [26].
Продемонстрирована профибротическая активность эпикардиальной жировой ткани, которая предположительно реализуется влиянием адипофиброкинов — тромбоспондина-1, активина А, принадлежащего к суперсемейству TGF-β и участвующего в патогенезе фиброза легких, почек и печени [27—29].
Авторы подчеркивают, что секреция адипофиброкинов осуществляется адипоцитами, а также фибробластами эпикардиального, а не подкожного жирового депо [30].
Кроме того, имеются данные об ассоциации степени фиброза миокарда с неблагоприятным долгосрочным прогнозом у больных с СН [31, 32].
Важно отметить, что фиброз выявляют в миокарде пациентов с СН, несмотря на проводимую комбинированную терапию, соответствующую современным рекомендациям [5, 6, 33], а степень фиброза рассматривают в качестве предиктора эффективности длительной терапии СН (в частности β-адрено-блокаторами) [34].
В этой связи очевидна необходимость выявления и оценки степени фиброза миокарда не только с точки зрения понимания клинической картины большинства ССЗ, но и для эффективного прогнозирования и адекватного лечения больных. Кроме того, развитие фиброза миокарда может являться механизмом, посредством которого возраст детерминирует развитие СН в общей популяции [35].
Вопрос относительно адекватной оценки количественных и качественных характеристик фиброза миокарда, особенно в клинической практике, стоит весьма остро.
В настоящее время стандартом верификации фиброза является гистопатологический анализ ткани миокарда (полученной при эндомиокардиальной биопсии) с определением объемной фракции коллагена (ОФК) I и III типов, а также оценкой их соотношения ОФКI/ОФКIII. Таким образом, фиброз миокарда характеризуется высокими значениями ОФК, ОФКI, ОФКIII и/или соотношения ОФКI/ОФКIII [36].
Однако вследствие неравномерного распределения коллагена в миокарде возможна ошибка при заборе материала, что может явиться ограничением диагностической ценности этой процедуры. Хотя E. Pearlman и соавт.
[37] показано наличие диффузного фиброза миокарда на основании результатов аутопсий пациентов с различными ССЗ без явлений СН, такие наблюдения характеризуют фиброз миокарда как генерализованный процесс, однако на практике гистопатологический анализ может не отражать полной картины и соответственно не предоставлять необходимую информацию относительно не столько наличия фиброза, сколько оценки его тяжести.
Следует отметить, что в качестве альтернативы эндомиокардиальной биопсии следует рассматривать неинвазивные методы диагностики, в частности МРТ сердца, с исследованием интерстициального пространства миокарда посредством измерения его внеклеточного объема с помощью Т1-взвешенных изображений. Так, у пациентов с различными заболеваниями сердца продемонстрирована корреляция между внеклеточным объемом миокарда, оцененным с помощью МРТ сердца, и ОФК [38]. Однако, несмотря на то что аккумуляция фиброзной ткани, приводящая к расширению интерстициального пространства, как правило, служит причиной увеличения внеклеточного объема миокарда, в дальнейшем изучении нуждается вопрос о возможности использования этого показателя в качестве объективного параметра оценки фиброза, сопоставимого с ОФК, оцененной гистологическим исследованием.
В этой связи особый интерес представляет выявление биомаркеров фиброза миокарда, доступных для определения в циркулирующей крови.
«Идеальный» маркер фиброза миокарда, безусловно, должен не только отражать наличие и степень выраженности фиброза, но также иметь ценность для стратификации риска неблагоприятного течения ССЗ и определения возможностей и подходов к рациональной терапии у конкретного пациента. Столь высокие требования к маркерам фиброза продиктованы практической потребностью и оценкой процесса фиброза как основополагающего звена патогенеза большинства ССЗ. Однако в настоящее время можно говорить лишь о продолжающемся поиске подобных маркеров, большинство из которых, демонстрируя свою ценность в экспериментальных работах, в клинической практике не соответствуют поставленным требованиям.
Так, связь между биомаркером и гистологическим подтверждением фиброза миокарда в большинстве случаев отсутствует или не имеет убедительной доказательной базы [4].
При переносе экспериментальных данных на клинический уровень нередко маркеры, прогностическая ценность которых в развитии фиброза миокарда подтверждается на моделях животных, не отражают наличия и выраженности фиброза у пациентов в определенных клинических ситуациях [4].
Обнаружена статистически значимая корреляция между уровнем С-концевого пропептида проколлагена I типа (карбоксиконцевого пропептида проколлагена I типа — PICP) в сыворотке крови и общей ОФК у пациентов с гипертонической болезнью с наличием [18, 39] и отсутствием СН [40], а также между концентрацией N-концевого пропептида проколлагена III типа (PIIINP) в сыворотке крови и ОФКIII у пациентов с СН на фоне ИБС и дилатационной кардиомиопатии (ДКМП) [41]. Интерес представляют данные об одновременном изменении (снижении) концентрации PICP и гистологического маркера — ОФК у пациентов с гипертонической болезнью без СН в ответ на лечение лозартаном [42], а при наличии СН — торасемидом [39]. Аналогичные изменения отмечены у больных ДКМП на фоне лечения спиронолактоном [43]; кроме того, уменьшение ОФК, отмеченное у этих пациентов, сопровождалось значительным снижением уровня PIIINP в сыворотке крови [43]. Однако и относительно описанных биомаркеров, имеющих на современном этапе наиболее убедительную доказательную базу диагностической эффективности, существует ряд вопросов, требующих дальнейшего изучения. Во-первых, остается неясным тканевое и органное происхождение PICP и PIIINP. Например, есть данные о высвобождении PICP [18], но не PIIINP [44] миокардом у пациентов с СН, напротив, при аортальном стенозе сообщают о чистом высвобождении из сердца PIIINP [45], другие исследователи не обнаружили его выделения в системный кровоток при ИБС и СН, ДКМП [46], а также у пациентов с ГКМП [47]. Во-вторых, диагностическая ценность этих маркеров существенно меняется в зависимости от заболевания. Так, связь между повышением концентрации PICP и ОФКI установлена у больных с СН на фоне ГКМП [18, 48] и отсутствовала при СН на фоне ИБС или ДКМП [46]; для PIIINP и ОФКIII выявлены противоположные закономерности [18, 48]. В-третьих, изменение концентрации этих биомаркеров в сыворотке крови у пациентов с ССЗ может свидетельствовать об общих изменениях сердечно-сосудистой системы, например при избытке коллагена I и III типов в артериальной стенке у пациентов с гипертонической болезнью [4]. И, наконец, наличие сопутствующих заболеваний (печеночной недостаточности, нарушения метаболизма костной ткани и др.), влияющих на метаболизм коллагена, также может существенно изменять концентрацию этих маркеров в крови [49]. Кроме того, обсуждая проблему верификации фиброза миокарда, следует подчеркнуть имеющиеся экспериментальные [50] и клинические [48, 51] данные о различном влиянии повышенного содержания коллагена на гемодинамику левого желудочка в зависимости от степени поперечной сшивки волокон коллагена, что подтверждает необходимость использования маркеров, также оценивающих соединительнотканную структуру миокарда [4].
Роль других биомаркеров, рассматриваемых с точки зрения их диагностической и прогностической ценности в верификации фиброза миокарда в клинической практике, окончательно не определена.
Так, отсутствует доказательная база относительно ценности матриксной металлопротеиназы-1 (ММП-1) [52], тканевого ингибитора ММП-1 (ТИМП-1) [52], остепонтина [53, 54], кардиотрофина-1 [55], которые нередко рассматриваются в качестве маркеров, верифицирующих фиброз.
Еще более внушителен список маркеров-кандидатов, роль которых нуждается в уточнении, — PICP [41, 43], ММП-2, 3, 8, 9, ТИМП-4, микроРНК-21 [56], TGF-1β [57, 58], фактор роста соединительной ткани [57], галектин-3 [57, 59] и др.
Одной из причин неоднозначной связи верифицированного фиброза с циркулирующими биомаркерами может служить их различная роль в процессе фиброза.
В частности, в ответ на стимуляцию альдостероном и ангиотензином макрофаги экспрессируют галектин-3, который является мощным стимулом пролиферации фибробластов и выработки избыточного количества коллагена [12, 60, 61], в то время как ММП выполняют функцию его резорбции. Кроме того, следует учитывать сложность взаимодействия различных биологически активных веществ в процессах регуляции, прогрессирования и регрессирования фиброза [12], причем эти динамичные процессы могут иметь свои особенности в различных органах, развиваясь с неодинаковой интенсивностью, приводя не только к нарушению функции органов, но и грубой структурной перестройке [62].
Важным аспектом изучения фиброза является не только его интерпретация в качестве типового патологического процесса, но и рассмотрение как системного поражения различных органов и тканей [12].
Так, механическое или ишемическое повреждения кардиомиоцитов способно стимулировать повреждение отдаленных органов (легких, почек, печени) посредством реакций врожденного иммунитета, нейрогуморальной активации и, возможно, продуктов метаболизма (например, каталитического железа) [63].
Существуют данные, доказывающие роль фиброза миокарда, легких и почек (путем переноса нейрогуморальной активации на уровень клеточных сигналов) в патогенезе и прогрессировании различных заболеваний [12], связанных с 1/3 всех смертельных исходов в мире [64].
С момента доказательства роли фиброза в развитии дисфункции различных органов, обеспечении системности большинства заболеваний, особенно на конечных стадиях развития, фиброз стали рассматривать в качестве перспективной терапевтической мишени.
Причем фиброгенез расценивается именно как динамичный процесс, способный к регрессу или существенному снижению темпов прогрессирования при определенных условиях [62]. В частности, устранение провоцирующего воздействия является одним из основных и эффективных терапевтических подходов.
Однако в современной практике наиболее реалистичной терапевтической целью является замедление прогрессирования фиброза, а не его регресс [62].
В частности, ингибиторы ангиотензинпревращающего фермента, антагонисты альдостерона, статины, применяемые для лечения больных с СН, оказывают антифибротические эффекты.
Такая терапия способна вызывать «обратное ремоделирование» сердца, уменьшать частоту аритмических ослонений, в частности желудочковой тахикардии [65, 66] и внезапной смерти [67]. Многообещающей представляется идея, основанная на экспериментальных данных о возможности трансформации фибробластов в кардиомиоциты [68, 69] с обеспечением нормальной регенерации миокарда.
Следует отметить, что фиброз различной локализации подтверждает возможность переноса нейрогуморальной активации на уровень клеточных сигналов, являясь одной из стадий патогенеза различных заболеваний.
Дальнейшее изучение фиброза миокарда, а также других органов и тканей направлено на получение информации о патогенезе большого числа заболеваний, повышение эффективности диагностики и прогнозирования их течения, а также патогенетически обоснованной терапии.
На современном этапе отмечается неуклонный рост ССЗ с развитием СН, в большинстве случаев фиброз миокарда является детерминантой неблагоприятного исхода.
В рамках этой концепции верификация фиброза, мониторирование темпов его прогрессирования, оценка антифибротической эффективности проводимого лечения представляют несомненную научную и практическую ценность.
Дальнейшее изучение и валидация биомаркеров фиброза позволят существенно повысить эффективность прогнозирования с возможностью выбора и оценки оптимальной лечебной и профилактической тактики ведения пациентов с ССЗ.
Конфликт интересов отсутствует.

 Пролапс митрального клапана (ПМК) – это сердечная аномалия, одна из самых распространённых патологий сердца. При наличии данной патологии створки митрального клапана провисают/выпячиваются в полость предсердия, это происходит в момент сокращения левого желудочка сердца. В результате такой сердечной аномалии может происходить регургитация, когда часть крови возвращается в левое предсердие. Данная патология относиться к доброкачественным (в отличие от пороков сердца, например), но также может иметь серьезные неприятные последствия, к сожалению. Регургитация тяжелой степени может стать причиной инвалидности. В одних случаях пролапс митрального клапана требует серьезного лечение (медикаментозного или даже хирургического), в других – врачи ограничиваются лишь наблюдением за пациентом, человек должен регулярно проходить обследования и следить за своим образом жизни.
Пролапс митрального клапана (ПМК) – это сердечная аномалия, одна из самых распространённых патологий сердца. При наличии данной патологии створки митрального клапана провисают/выпячиваются в полость предсердия, это происходит в момент сокращения левого желудочка сердца. В результате такой сердечной аномалии может происходить регургитация, когда часть крови возвращается в левое предсердие. Данная патология относиться к доброкачественным (в отличие от пороков сердца, например), но также может иметь серьезные неприятные последствия, к сожалению. Регургитация тяжелой степени может стать причиной инвалидности. В одних случаях пролапс митрального клапана требует серьезного лечение (медикаментозного или даже хирургического), в других – врачи ограничиваются лишь наблюдением за пациентом, человек должен регулярно проходить обследования и следить за своим образом жизни.