Риск развития миелодиспластического синдрома повышается с возрастом. Гематологи отмечают, что в 4 из 5 случаев патология встречается у пациентов старше 60 лет, при этом мужчины болеют немного чаще, чем женщины. Патология может как протекать бессимптомно, так и стать причиной тяжелых нарушений работы всего организма. Кроме того, она значительно повышает риск развития лейкоза.
Классификация миелодиспластического синдрома основана на изменениях в клеточном составе крови и костном мозге. Выделяют следующие типы патологии:
- рефрактерная анемия;
- рефрактерная анемия с кольцевыми сидеробластами;
- рефрактерная цитопения с многолинейной дисплазией;
- рефрактерная анемия с избытком бластов тип 1 и тип 2;
- миелодиспластический синдром, ассоциированный с делецией 5q;
- неклассифицируемый миелодиспластический синдром.
Точное определение типа патологии дает возможность подобрать соответствующую терапию и определить прогноз.
Преобладающие признаки миелодиспластического синдрома зависят от изменений в анализе крови и особенностей течения заболевания. При легкой форме патология не проявляет себя и обнаруживается только при выполнении общего анализа крови. При значительном дефиците тех или иных клеток пациент может жаловаться на следующие проблемы:
- анемия: сопровождается слабостью, одышкой при минимальной физической нагрузке, частыми головокружениями и обмороками, бледностью кожи;
- нарушения свертываемости крови: связаны с нехваткой тромбоцитов; человек жалуется на частые кровотечения из носа и десен, синяки и точечные кровоизлияния на коже, у женщин увеличивается длительность и интенсивность месячных;
- снижение иммунитета: нехватка отдельных фракций лейкоцитов сопровождается повышением частоты и тяжести ОРВИ, частыми воспалениями слизистых оболочек и кожи, увеличением риска развития пневмоний, синуситов, сепсиса и других воспалительных заболеваний.
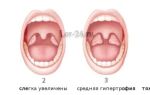
Одним из классических симптомов миелодиспластического синдрома является увеличение лимфатических узлов, печени и селезенки.
В большинстве случаев точную причину развития миелодисплазии определить не удается. Выявлена связь между риском заболевания и неблагоприятной экологической обстановкой, хроническими интоксикациями, повышенным радиационным фоном, курением, а также некоторыми наследственными патологиями.
Существует также вторичный тип заболевания, развивающийся на фоне проведения агрессивной химиотерапии или лучевого лечения. В этом случае патология может обнаружиться в любом возрасте. Она отличается более агрессивным течением и стойкостью к лечению.
Получить консультацию
Если у Вас наблюдаются подобные симптомы, советуем записаться на прием к врачу. Своевременная консультация предупредит негативные последствия для вашего здоровья.
Узнать подробности о заболевании, цены на лечение и записаться на консультацию к специалисту Вы можете по телефону:
+7 (495) 292-39-72
Заказать обратный звонок Записаться онлайн
Почему «СМ-Клиника»?
1
Лечение в соответствии с мировыми клиническими рекомендациями
2
Комплексная оценка заболевания и прогноза лечения
3
Современное диагностическое оборудование и собственная лаборатория
4
Высокий уровень сервиса и взвешенная ценовая политика
Диагностика миелодиспластического синдрома основана на исследовании крови и образцов костного мозга.
Если пациент предъявляет жалобы, которые могут свидетельствовать о развитии патологии, ему в обязательном порядке выполняют общий анализ крови с расширенной лейкоцитарной формулой.
Как правило, в образцах выявляется анемия, нехватка лейкоцитов или тромбоцитов. Пункция костного мозга позволяет выявить характерные изменения, свидетельствующие о нарушении нормального процесса кроветворения.
Помимо этих проб, назначаются дополнительные анализы, направленные на оценку функции органов и тканей, а также исключение других заболеваний со сходными симптомами (лейкозы, апластическая анемия, дефицит витамина В12 и т.п.).
Миелодисплазия – это заболевание со множеством масок. В одних случаях оно никак не проявляет себя, в других сопровождается кровоточивостью или оказывает влияние на систему иммунитета. Особенности каждого типа патологии и тяжесть течения определяют прогноз.
Если при относительно легких формах срок выживаемости при адекватно подобранном лечении измеряется десятками лет, то в тяжелых случаях средний срок жизни после постановки диагноза составляет не более 1 года.
Именно поэтому так важно при любых подозрениях на миелодиспластический синдром, равно как и на любое другое гематологическое заболевание как можно быстрее пройти полную диагностику и начать терапию.
Тактика лечения миелодисплазии зависит от результатов анализов крови и пункции костного мозга, а также тяжести симптоматики. Как правило, врачи используют комбинированный подход, включающий:
- препараты для подавления иммунитета (блокируют размножение патологических клеток);
- различные виды химиотерапии;
- пересадку костного мозга;
- симптоматическое лечение: переливание крови и ее компонентов, купирование инфекционных осложнений, нормализацию работы системы свертывания крови.
Подбор конкретных методик и препаратов осуществляется в индивидуальном порядке.
Специфических мер профилактики миелодисплазии не существует. Рекомендуется избегать интоксикаций, избыточного воздействия ионизирующего излучения, сократить курение или полностью отказаться от него. Также необходимо регулярно проходить скрининговое обследование, куда входит общий анализ крови, чтобы вовремя выявить негативные изменения.
Пациенты с миелодисплазией должны регулярно наблюдаться у гематолога даже при длительной и стойкой ремиссии. Регулярное выполнение анализов крови позволит держать состояние под контролем и оперативно реагировать на любые изменения.
Рукавицын Олег Анатольевич, Архипова Наталья Васильевна, Агеева Татьяна Августовна, Поп Василий Петрович. Гематология. Национальное руководство. ГЭОТАР-Медиа, 2017 г.
Таратухин Е. О., Соболева В. Н., Обруч В. С., Манякина Е. В., Люсов В. А. Миелодисплазия: уже лейкоз или еще нет? // Лечебное дело. 2008. №2.
Дьячкова Наталья Юрьевна, Ковынев Игорь Борисович, Воропаева Елена Николаевна, Шамаева Галина Викторовна, Лямкина Анна Сергеевна Влияние вторичной миелодисплазии на выживаемость пациентов со злокачественными лимфомами // Сибирский научный медицинский журнал. 2011. №2.
Кохно Алина Владимировна, Паровичникова Елена Николаевна, Савченко Валерий Григорьевич Миелодиспластический синдром // Клиническая геронтология. 2009. №3.
Афанасьев Борис Владимирович, Зубаровская Л.С. Миелодиспластический синдром у детей // РЖДГиО. 2018. №3.
Лицензии
Перейти в раздел лицензииПерейти в раздел правовая информация
Миелодиспластический синдром
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет.
Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста.
Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим.
Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии.
Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Миелодиспластический синдром
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается.
В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания.
В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан).
Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение.
Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра.
При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
https://www.youtube.com/watch?v=8ic_oheTHhw\u0026t=1s
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии.
Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами.
У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов.
В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% — нейтропения и лейкопения.
У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз.
У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения.
Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение.
При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию.
При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови.
При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга.
Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга.
Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска.
Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев.
Вероятность отторжения костного мозга после трансплантации – около 10%.
Миелодиспластический синдром
Миелодиспластический синдром относится к группе гематологических заболеваний, при которых нарушается нормальная работа органов кроветворения и изменяются основные показатели крови. Выявляется чаще у лиц трудоспособного возраста, у детей встречается редко. Особую актуальность для современной медицины миелодиспластический синдром приобрел, потому что он повышает риск развития лейкоза.
Виды миелодиспластического синдрома
В зависимости от факторов, которые послужили причиной развития заболевания, выделяют два основных вида миелодиспластического синдрома.
- идиопатический, или первичный. Является самым распространенным и характерен для лиц старшей возрастной группы (после 60 лет). Точные причины, которые способствовали развитию заболевания, установить трудно. Среди них могут быть вредные привычки (курение), неблагоприятная экологическая обстановка, работа во вредных условиях труда и т. д. Первичный миелодиспластический синдром часто выявляется у пациентов с нейрофиброматозом, синдромом Дауна и другими генетическими заболеваниями;
- вторичный. Обычно возникает у пациентов, которые прошли лучевую или химиотерапию. Данный вариант заболевания является самым неблагоприятным, он плохо поддается лечению и имеет высокий риск перерождения в острый лейкоз.
Существует более подробная классификация миелодиспластического синдрома, которая разработана экспертами ВОЗ. Она учитывает количество бластов в периферической крови, степень дисплазии костного мозга и общие показатели крови.
В этой классификации выделяется форма миелодиспластического синдрома, которая ассоциирована с делецией длинного плеча 5-й хромосомы.
Медико-генетический центр «Геномед» имеет необходимое оборудование для того, чтобы выявить данную мутацию.
Симптомы
Заболевание характеризуется нарушением кроветворения, поэтому клиническая картина будет зависеть от степени выраженности этих нарушений. Обычно для миелодиспластического синдрома характерны следующие проявления:
- бледность кожных покровов;
- слабость, быстрая утомляемость, невозможность выполнять физическую работу;
- частые обмороки;
- постоянные головокружения;
- частые носовые кровотечения;
- точечные кровоизлияния на коже (петехии);
- увеличение размеров печени, лимфатических узлов, селезенки;
- характерные изменения в крови (цитопения, тромбоцитоз, анемия, наличие бластов и телец ауэра, повышенное содержание моноцитов и др.).
Если миелодиспластический синдром протекает в мягкой форме, то первые признаки могут появиться нескоро, а степень их выраженности обычно слабая. Длительное скрытое течение и стертая симптоматика не вызывает у пациентов настороженности и не заставляет обращаться за медицинской помощью, поэтому заболевание часто выявляется случайно.
Диагностика
Для того чтобы достоверно подтвердить миелодиспластический синдром, необходимо пройти комплексное гематологическое обследование, в которое включаются:
- общий анализ крови с формулой;
- биопсия костного мозга;
- цитологическое исследование;
- цитохимический метод;
- цитогенетическое исследование.
Хромосомные нарушения выявляются у 75 % больных, поэтому дополнительно назначается генетическое исследование.
Лечение миелодиспластического синдрома
План лечения составляется согласно тяжести заболевания и степени выраженности изменений в показателях крови.
Если у пациента не выявляется анемия, геморрагические проявления и сопутствующие осложнения, то лечение в таких случаях не проводится, но необходимость в регулярном контроле и наблюдении сохраняется.
Если же нарушения выражены существенно, выявлен высокий риск развития лейкоза, то назначается терапия, направленная на подавление иммунных реакций, возможна химиотерапия, регулярные переливания крови и ее компонентов, в тяжелых случаях пересадка костного мозга.
Продолжительность жизни пациентов с миелодиспластическим синдромом зависит от клинических проявлений и успешности лечения. В лучшем случае она составляет 10 лет и более, а в самых худших – меньше года.
Миелодиспластический синдром — симптомы и лечение | Спиженко
Термин «миелодиспластический синдром» (сокращённо МДС) объединяет различные патологии, при которых обнаруживаются цитопения (понижение концентрации форменных элементов крови), дисплазия (неправильное развитие) гемоцитобластов (предшественников кровяных клеток), гипоклеточность или гиперклеточность костного мозга.
МДС в 30-40% случаев трансформируется в острый миелолейкоз (онкологию крови). (https://cyberleninka.ru/article/n/mielodisplasticheskiy-sindrom/viewer)
МДС встречается достаточно редко – 3-5 случаев на 100 тысяч населения. Но после 60 лет частота болезни повышается до 20-40 случаев (https://www.eduherald.ru/pdf/2021/2/20538.pdf).
Причины болезни
Точные причины МДС пока не удалось установить. Известно, что в 10-20% случаев патология развивается у людей, проходивших лучевую или химиотерапевтическую терапию (https://cyberleninka.ru/article/n/mielodisplasticheskiy-sindrom/viewer).
Ученые предполагают, что спровоцировать миелоидный синдром способен также парвовирус В19.
Повышают риск возникновения патологии постоянная работа с некоторыми химическими веществами (пестицидами, бензином, органическими растворителями), неблагоприятная экологическая ситуация, курение, некоторые врожденные и наследственные болезни.
Под влиянием повреждающих факторов в стволовых клетках возникают мутации, которые способствуют развитию МДС. Постепенно они накапливаются, способствуя переходу болезни в лейкоз.
Симптомы патологии
Признаки МДС зависят от того, дефицит каких кровяных клеток испытывает организм.
Выделяют 3 группы клинических проявлений:
- Анемический синдром. Наблюдается при пониженной концентрации эритроцитов либо гемоглобина. Кожа и слизистые приобретают бледный окрас, в ушах появляется шум. Человек страдает от головокружений и одышки. Он становится раздражительным, быстро устает, даже минимальные физические нагрузки причиняют усиленное сердцебиение.
- Геморрагический синдром. Следствие уменьшения числа тромбоцитов. Сопровождается усиленной кровоточивостью: носовыми, десневыми, желудочно-кишечными, маточными кровотечениями, кровоизлияниями.
- Лейкопения. Развивается при снижении уровня лейкоцитов. В результате ослабляется иммунная система, что способствует присоединению различных инфекций, повышению температуры тела.
У некоторых пациентов в число симптомов миелодиспластического синдрома входят увеличение размеров селезенки (спленомегалия) и печени (гепатомегалия).
Диагностика МДС
Основной метод диагностики миелодиспластического синдрома – исследование крови. При МДС возможно понижение как одного показателя, так и их комбинация. Диагноз ставят только при устойчивой (не менее полугода) цитопении, если не найдены другие причины.
Если возникает подозрение на миелодиспластический синдром, делают трепанобиопсию и пункцию костного мозга. Полученный биоматериал подвергают гистологическому и цитологическому исследованию.
Чтобы исключить другие причины цитопении, пациента направляют на дополнительные лабораторные и инструментальные исследования, которые могут включать:
Цитопения сопровождает различные заболевания. Поэтому важно исключить другие причины: рак, аутоиммунные заболевания, хронические инфекции, нарушение гемопоэза, отравление бензином или тяжелыми металлами, нехватку меди, избыток цинка, побочное действие лекарств.
Чтобы дифференцировать миелодиспластический синдром от миелоидного лейкоза, определяют число бластных клеток. Согласно ВОЗ, если показатель превышает 20%, то диагностируют острый лейкоз (https://cyberleninka.ru/article/n/mielodisplasticheskiy-sindrom/viewer).
Лечение МДС
- Выбор способа лечения зависит от степени и прогрессирования цитопении, группы риска, имеющихся сопутствующих заболеваний.
- В зависимости от числа бластов, цитопений, выявленных генетических изменений выделяют 4 группы риска: высокий, промежуточный 1, промежуточный 2, низкий.
- Единственный действенный метод лечения, обеспечивающий лечение, – пересадка костного мозга.
Все остальные способы направлены на ослабление неприятной симптоматики, предотвращение осложнений, улучшение качества жизни.
Но из-за высокого риска осложнений, включая возможность смертельного исхода, отсутствия доноров трансплантацию предлагают только 5-10% больных. Обычно пересадку стволовых клеток рекомендуют пациентам моложе 65 лет с промежуточным-2 и высоким риском при наличии идентичного донора.
Выделяют 3 основные способа лечения:
- Высокоинтенсивная терапия, включающая пересадку стволовых клеток и полихимиотерапию. Назначают пациентам, входящим в группу высокого или промежуточного риска 2. При проведении химиотерапевтической терапии применяют эпигенетические модуляторы Азацитидин и Децитабин (облегчают симптоматику, предотвращают переход в острый миелолейкоз), иммуномодулятор Леналидомид (блокирует ангиогенез опухолевых клеток, уменьшает потребность в переливании крови).
- Низкодозная химиотерапия в комбинации с заместительной и иммуносупрессивной терапией. Проводят при низком и промежуточном риске 1.
- Симптоматическое и поддерживающее лечение. Позволяет повысить качество жизни и увеличить ее продолжительность.
o При анемическом синдроме назначают эритропоэтины, вливают эритроцитарную массу. Но при неоднократном проведении процедуры возможна перегрузка железом, что требует хелатной терапии.
- o Чтобы купировать либо предотвратить кровоточивость, прибегают к трансфузии тромбоцитов.
- o При гипопластическом типе кроветворения эффективное действие оказывают иммунодепрессанты, которые защищают костный мозг от иммунной атаки.
- В клинике Спиженко лечение подбирают индивидуально для каждого пациента в соответствии с международными рекомендациями и утвержденными протоколами.
Русский Медицинский Сервер — Гематология и трансфузиология — Миелодиспластический синдром
МИЕЛОДИСПЛАСТИЧЕСКИЙ СИНДРОМ. (ЧАСТЬ 2)
Клиника. Диагностика. Лечение.
(лекция для врачей и студентов)
А.В.Колосков
Клиническая картина. Клиническая картина при различных формах МДС схожа и во многом определяется показателями периферической крови. Изменения периферической крови прямо зависят от степени нарушения созревания гемопоэтических клеток. Анемия постоянный и обязательный признак.
Для нее характерны гиперхромия (высокий цветовой показатель) и макроцитоз. Уровень снижения гемоглобина может варьировать от умеренного до значительного. От степени и скорости нарастания анемии будет зависеть самочувствие больного.
При медленном снижении гемоглобина организм успевает адаптироваться к гипоксии и количество жалоб у больных может быть минимальным. Если анемия развивается быстро, больные предъявляют жалобы на общую слабость, утомляемость, сердцебиение, одышку.
Может утяжеляться течение ишемической болезни сердца, появляются признаки сердечной недостаточности.
Снижение количества зрелых гранулоцитов (нейтропения), а также их функциональная несостоятельность влекут за собой инфекционные осложнения. У 10 % больных развиваются стоматиты, гингивиты, пневмонии, инфекция мочевыводящих путей, абсцессы различной локализации, сепсис. У 20 % больных данной группы инфекционные осложнения становятся причиной смерти.
Наиболее многочислены осложнения бактериальной природы, возбудителями которых являются Escherichia coli, Pseudomonas pyocyanea, Klebsiella pneumoniae, Staphylococcus aureus и Streptococcus fecalis.
Также достаточно часто тяжелые инфекционные осложнения вызываются Pneumocystic carinii, Cryptococcus neoformous, Candida albicaus, Aspergillus fumigatus и цитомегаловирусом, что связано с функциональной неполноценностью Т-лимфоцитов при МДС.
Клинически значимая тромбоцитопения (приводящая к развитию геморрагического диатеза с петехиально-пятнистым типом кровоточивости) встречается у 15 % больных МДС. У половины из них кровотечение или кровоизлияния становятся причиной смерти.
В некоторых случаях МДС, как правило у больных рефрактерной анемией, может отмечаться тромбоцитоз.
Проявления гиперпластического синдрома в виде спленомегалии, гепатомегалии, лимфоаденопатии и специфического поражения кожи (лейкемиды) имеют место в основном у больных ХММЛ.
Спленомегалия встречается у 17 % таких больных, гепатомегалия у 13 %, а лейкемиды у 10 %.
Диагностика.
Отправной точкой диагностического поиска являются, как правило, жалобы связанные со снижением уровня гемоглобина, подкрепляемые выявлением гиперхромной, макроцитарной анемии при исследовании периферической крови. Выявление при первичном осмотре, наряду с анемическими жалобами, явлений геморрагического диатеза и/или гиперпластического синдрома позволяют сформировать представление о
патологии системы крови еще до получения результатов лабораторных исследований. Наличие би- или трицитопении в периферической крови является абсолютным показанием для морфологического исследования костного мозга.
При исследовании аспирата костного мозга у больных МДС в большинстве случаев определяется гиперплазия всех ростков кроветворения и обязательно выявляются признаки дисплазии клеток (смотри «Миелодиспластический синдром. Часть 1»).
Максимальную информативность имеет гистологическое исследование костного мозга, получаемого методом трепанобиопсии. Гистологическое исследование позволяет обнаружить высоко специфичную для МДС морфологическую картину.
В качестве вспомогательного метода диагностики может быть использовано цитогенетическое исследование кариотипа гемопоэтических клеток. Различные хромосомные поломки выявляются у 48 % больных МДС.
Частота аномалий кариотипа варьирует в зависимости от нозологического варианта МДС. Так у больных РА хромосомные поломки обнаруживаются в 30 % случаев, а у больных РАИБтранс в 60 %.
Выявление хромосомных аномалий имеет большое значение для определения прогноза течения заболевания.
Наиболее часто встречающимся изменением кариотипа у больных РА является делеция (утрата) части длинного плеча пятой хромосомы (5q-). Данная аномалия чаще выявляется у женщин (соотношение мужчин и женщин среди заболевших составляет 1:5).
Для больных с такой хромосомной поломкой характерны ярко выраженые морфологические аномалии мегакариоцитов (микромегакариоциты), тромбоцитоз периферической крови и достаточно благоприятное течение заболевания с низкой частотой трансформации в острый лейкоз.
- Диагноз складывается из морфологически подтвержденного представления о наличии у больного миелодиспластического синдрома и окончательно формулируется (нозологическая форма) на основании количественных критериев миелограммы и гемограммы (FAB-классификация):
- РА — бласты костного мозга < 5%, кольцевые сидеробласты 15%, бласты периферической крови < 1%, моноциты периферической крови < 1x10^9/л;
- РАИБ — бласты костного мозга 5 -20%, кольцевые сидеробласты — любое количество , бласты периферической крови < 5%, моноциты периферической крови < 1x10^9/л;
- РАИБТ — бласты костного мозга 20-30%, кольцевые сидеробласты — любое количество , бласты периферической крови > 5%, моноциты периферической крови < 1x10^9/л;
- ХММЛ — бласты костного мозга < 20%, кольцевые сидеробласты - любое количество, бласты периферической крови < 1%, моноциты периферической крови > 1×10^9/л;
Дифференциальный диагноз. Направление дифференциально-диагностического поиска будет зависеть от характера изменений гемограммы. Выявление гиперхромной, макроцитарной анемии как моносимптома или в сочетании с нейтропенией и/или тромбоцитопенией делает необходимым проведение дифференциального диагноза МДС с:
- — витамин В12-дефицитной анемией;
- — фолиеводефицитной анемией;
- — апластической анемией;
- — пароксизмальной ночной гемоглобинурии;
- — гипопластическим и алейкемическим вариантами острого лейкоза;
- — метастазами рака в костный мозг.
- При выявлении в анализе периферической крови би- или трицитопении, бластов, промиелоцитов и миелоцитов, является абсолютным показанием для гистологического исследования костного мозга, сводящего вопрос о дифференциальном диагнозе к минимуму.
Лечение. Для лечение больных рефрактерной анемией (РА) используется заместительно-трансфузионная и симптоматическая терапия. Зависимость от трансфузий эритроцитарной массы может колебаться в широких пределах. При наличии глубокой тромбоцитопении и/или тяжелых проявлений геморрагического диатеза показаны трансфузии тромбоцитарной массы.
Длительная заместительная терапия эритроцитарной массой со временем приводит к избыточному накоплению железа в организме. В связи с этим, больным необходимо мониторировать уровень сывороточного железа. При увеличении его содержания свыше 30 мкмоль/л необходимо вводить десферал для профилактики гемосидероза внутренних органов.
Химиотерапия больным РА не проводится. Применение глюкокортикоидов, андрогенов, анаболических препаратов иногда имеет положительный эффект, но длительность выживания больных не возрастает. Кроме того, доказано, что при лечении препаратами этих групп увеличивается частота трансформации в острый лейкоз.
Рефрактерная анемия с кольцевыми сидеробластами (РАС) является самой доброкачественной формой МДС. Зависимость от гемотрансфузий у больных РАС невысока. В другой терапии они, как правило, не нуждаются и длительно сохраняют высокое качество жизни.
Единственным методом лечения больных РАИБ и РАИБтранс, позволяющим рассчитывать на излечение является аллогенная трансплантация костного мозга. При отсутствии донора, больным РАИБ и РАИБтранс показана химиотерапия. Лечение цитостатиками начинают у больных с количеством бластов в костном мозге свыше 10%.
Применение интенсивной химиотерапии позволяет добиться ремиссии у 20-30 % больных, но, к сожалению, длительность ремиссии не превышает в среднем двух месяцев и не влияет на общую продолжительность жизни больного. В качестве базисного препарата для химиотерапии используется цитозар. Применяется также этопозид и рубомицин. Дозы и схемы введения различны.
Проведение химиотерапии позволяет уменьшить зависимость больных от гемотрансфузий и продлить длительность жизни.
Больные ХММЛ в дебюте заболевания нуждаются только в трансфузионной и симптоматической терапии. При увеличении количества бластов возникают показания к цитостатической терапии. Базисным препаратом для проведения химиотерапии у больных ХММЛ является этопозид.
При развитии острого лейкоза у больных любой формой МДС как правило проводится полихимиотерапия принятая для данного варианта острого лейкоза. Следует отметить, что острый лейкоз, развившийся из предшествующего МДС, плохо поддается терапии. Ремиссию удается получить редко и она не продолжительна.
Прогноз. Длительность выживания больных РА и РАС составляет в среднем 3 — 4 года.
При адекватной трансфузионной терапии больные достаточно длительный период времени сохраняют хорошее качество жизни и могут быть трудоспособны. Прогноз у больных ХММЛ несколько хуже, а у больных РАИБ и РАИБтранс плохой.
Длительность выживания больных при трансформации любой из нозологических форм МДС в острый лейкоз ограничивается 4 — 6 месяцами.
[an error occurred while processing this directive]
Описание миелодиспластических синдромов — Больница Шиба
Миелодиспластические синдромы (МДС) – это группа злокачественных заболеваний, которые происходят из тканей костного мозга и влияют на рост клеток крови, что приводит к нарушению нормального функционирования организма. Примерно в каждом третьем случае МДС переходит в острый миелоидный лейкоз (ОМЛ) – заболевание, при котором клетки крови начинают бесконтрольно размножаться.
Первоначально миелодиспластические синдромы рассматривались как предлейкозные состояния и были классифицированы как отдельные нарушения только в 1976 году. В общей совокупности населения МДС встречается относительно редко, однако среди пожилых людей старше 60 лет заболеваемость составляет 20-50 случаев на каждые 100000 человек.
При миелодиспластических синдромах стволовые клетки крови не развиваются должным образом и не превращаются в здоровые тромбоциты, эритроциты или лейкоциты. Поскольку данные клетки остаются незрелыми, они не могут нормально функционировать и погибают либо в костном мозге, либо вскоре после попадания в кровоток. Вследствие этого в организме пациента развивается нехватка здоровых клеток крови.
- Пожилой возраст: в большинстве случаев МДС диагностируется у пожилых людей в возрасте от 70 до 80 лет.
- Пол: МДС чаще встречается у мужчин, чем у женщин. Причина этого явления неизвестна.
- Предшествующая химиотерапия онкологического заболевания: лечение рака некоторыми химиотерапевтическими препаратами повышает риск развития МДС.
- Генетические синдромы: пациенты с некоторыми наследственными синдромами имеют более высокий риск развития МДС. С развитием МДС связаны следующие генетические заболевания: анемия Фанкони, синдром Швахмана-Даймонда, анемия Даймонда-Блекфена, семейная тромбоцитопатия с предрасположенностью к развитию миелоидных злокачественных опухолей, тяжелая врожденная нейтропения и врожденный дискератоз.
- Наличие МДС в семейном анамнезе: определенная генетическая мутация, присутствующая в семейном анамнезе, может повышать риск возникновения МДС.
- Курение: канцерогенные вещества, содержащиеся в табачном дыме, всасываются в кровь при ее прохождении через легкие и распространяются по всему организму.
- Воздействие факторов окружающей среды: длительный контакт с химическими веществами, которые используются в резиновой и нефтяной промышленности (бензол и др.), может повышать риск развития МДС. Кроме того, воздействие высоких доз радиации (как, например, при аварии на ядерном реакторе) также повышает риск развития заболевания.
Миелодиспластические синдромы приводят к снижению уровней показателей крови, поэтому ранние симптомы болезни связаны с дефицитом одного или нескольких типов клеток крови.
- Анемия (пониженное содержание эритроцитов) может вызвать следующие симптомы:
- Усталость;
- Головокружение;
- Слабость;
- Бледность кожного покрова;
- Одышка;
- Головные боли.
- Лейкопения (пониженное содержание лейкоцитов) может вызвать следующие симптомы:
- Частые или тяжелые инфекционные заболевания.
- Тромбоцитопения (пониженное содержание тромбоцитов) может вызвать следующие симптомы:
- Кровоточивость и/или появление синяков при незначительном воздействии;
- Частые или сильные носовые кровотечения;
- Кровоточивость десен.
Существует несколько типов МДС, различающихся по степени поражения клеток крови и костного мозга. Согласно системе Всемирной организации здравоохранения (ВОЗ), классификация МДС осуществляется на основе внешнего вида клеток под микроскопом и количества аномальных клеток.
- МДС с мультилинейной дисплазией: наблюдается поражение двух или более типов клеток крови.
- МДС с однолинейной дисплазией: поражены преимущественно эритроциты.
- МДС с кольцевыми сидеробластами: эритроциты не могут перерабатывать железо, необходимое для выработки гемоглобина. Вместо этого молекулы железа образуют кольцо вокруг ядер развивающихся эритроцитов.
- МДС с избытком бластов: наблюдается поражение одного или более типов клеток крови с избыточным содержанием бластных клеток в крови и в костном мозге.
- МДС с делецией 5q: наблюдается поражение эритроцитов, вызывающее анемию. В костном мозге и в крови присутствует небольшое количество бластных клеток.
- МДС неклассифицируемый.
МДС также классифицируется на основе клинической картины, относящейся к первопричине болезни. Если причина не установлена, то МДС называется первичным (наиболее распространенный тип). Когда причина заболевания известна – это вторичный МДС. Диагностика типа МДС играет важную роль в выборе оптимального курса лечения.
При миелодиспластических синдромах стволовые клетки крови не развиваются должным образом и не превращаются в здоровые тромбоциты, эритроциты или лейкоциты. Поскольку данные клетки остаются незрелыми, они не могут нормально функционировать и погибают либо в костном мозге, либо вскоре после попадания в кровоток. Вследствие этого в организме пациента развивается нехватка здоровых клеток крови.
Существует несколько известных факторов риска развития миелодиспластических синдромов.
- Пожилой возраст: в большинстве случаев МДС диагностируется у пожилых людей в возрасте от 70 до 80 лет.
- Пол: МДС чаще встречается у мужчин, чем у женщин. Причина этого явления неизвестна.
- Предшествующая химиотерапия онкологического заболевания: лечение рака некоторыми химиотерапевтическими препаратами повышает риск развития МДС.
- Генетические синдромы: пациенты с некоторыми наследственными синдромами имеют более высокий риск развития МДС. С развитием МДС связаны следующие генетические заболевания: анемия Фанкони, синдром Швахмана-Даймонда, анемия Даймонда-Блекфена, семейная тромбоцитопатия с предрасположенностью к развитию миелоидных злокачественных опухолей, тяжелая врожденная нейтропения и врожденный дискератоз.
- Наличие МДС в семейном анамнезе: определенная генетическая мутация, присутствующая в семейном анамнезе, может повышать риск возникновения МДС.
- Курение: канцерогенные вещества, содержащиеся в табачном дыме, всасываются в кровь при ее прохождении через легкие и распространяются по всему организму.
- Воздействие факторов окружающей среды: длительный контакт с химическими веществами, которые используются в резиновой и нефтяной промышленности (бензол и др.), может повышать риск развития МДС. Кроме того, воздействие высоких доз радиации (как, например, при аварии на ядерном реакторе) также повышает риск развития заболевания.
Миелодиспластические синдромы приводят к снижению уровней показателей крови, поэтому ранние симптомы болезни связаны с дефицитом одного или нескольких типов клеток крови.
- Анемия (пониженное содержание эритроцитов) может вызвать следующие симптомы:
- Усталость;
- Головокружение;
- Слабость;
- Бледность кожного покрова;
- Одышка;
- Головные боли.
- Лейкопения (пониженное содержание лейкоцитов) может вызвать следующие симптомы:
- Частые или тяжелые инфекционные заболевания.
- Тромбоцитопения (пониженное содержание тромбоцитов) может вызвать следующие симптомы:
- Кровоточивость и/или появление синяков при незначительном воздействии;
- Частые или сильные носовые кровотечения;
- Кровоточивость десен.
- Дополнительные симптомы:
- Повышенная температура тела;
- Боли в костях;
- Потеря веса;
- Отсутствие аппетита.
Существует несколько типов МДС, различающихся по степени поражения клеток крови и костного мозга. Согласно системе Всемирной организации здравоохранения (ВОЗ), классификация МДС осуществляется на основе внешнего вида клеток под микроскопом и количества аномальных клеток.
Система классификации ВОЗ выделяет шесть основных типов миелодиспластических синдромов:
- МДС с мультилинейной дисплазией: наблюдается поражение двух или более типов клеток крови.
- МДС с однолинейной дисплазией: поражены преимущественно эритроциты.
- МДС с кольцевыми сидеробластами: эритроциты не могут перерабатывать железо, необходимое для выработки гемоглобина. Вместо этого молекулы железа образуют кольцо вокруг ядер развивающихся эритроцитов.
- МДС с избытком бластов: наблюдается поражение одного или более типов клеток крови с избыточным содержанием бластных клеток в крови и в костном мозге.
- МДС с делецией 5q: наблюдается поражение эритроцитов, вызывающее анемию. В костном мозге и в крови присутствует небольшое количество бластных клеток.
- МДС неклассифицируемый.
МДС также классифицируется на основе клинической картины, относящейся к первопричине болезни. Если причина не установлена, то МДС называется первичным (наиболее распространенный тип). Когда причина заболевания известна – это вторичный МДС. Диагностика типа МДС играет важную роль в выборе оптимального курса лечения.










 Перейти в раздел лицензииПерейти в раздел правовая информация
Перейти в раздел лицензииПерейти в раздел правовая информация