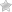Спастичность – это состояние повышенного мышечного тонуса. Движения пациента при этом становятся скованными, человеку трудно передвигаться, говорить, совершать любые движения.
Во избежание постановки некорректного диагноза обращайтесь за консультацией к квалифицированным врачам Юсуповской больницы, которая оборудована современной медицинской аппаратурой. Здесь Вы можете пройти полную диагностику и получить адекватное лечение.
Спастичность скелетных мышц при неврологических заболеваниях
Спастичность скелетных мышц возникает вследствие многих неврологических заболеваний, в частности, рассеянного склероза, спинальной и черепно-мозговой травм, детского церебрального паралича, инсульта.
К спастичности скелетных мышц могут приводить:
- поражения головного мозга по причине нехватки кислорода (гипоксии)
- менингит – воспаление тканей оболочек головного мозга
- энцефалит – воспаление тканей головного мозга
- фенилкетонурия и пр.
Все вышеперечисленные заболевания могут привести к тяжелым осложнениям и последствиям. Поэтому при малейших недомоганиях обязательно необходимо обращаться за медицинской помощью. Чем раньше диагностируется заболевание, тем легче оно поддается лечению.
Лечение всех неврологических заболеваний – процесс непростой и достаточно длительный. Только опытный и высококвалифицированный врач может установить истинную причину недуга и назначить правильное и эффективное лечение.
Спастичность и ригидность
Ригидность – это устойчивое повышение тонуса мышц и сопротивления при попытке сделать какое-либо движение. Пациент не может согнуть и разогнуть конечности. В отличие от спастичности, ригидность остается постоянной во всем объеме пассивного движения.
Ригидность возникает по причине поражения среднего мозга, а также черной субстанции. Данное состояние является основным признаком болезни Паркинсона.
Спастичность ног при центральном параличе
Люди с центральным параличом имеют поражения головного мозга. При поражении тех участков клеток, которые отвечают за тонус мышц, возникает спастичность мышечных тканей конечностей. При врожденном центральном параличе деформация конечностей появляется не сразу, а постепенно.
Спастичность при множественном склерозе
На фоне множественного склероза развиваются два вида спастичности – сгибательная и разгибательная. В первом случае колени и бедра сгибаются и прижимаются к груди. Во втором случае у пациентов наблюдается непроизвольное выпрямление ног.
Спастичность при травмах головы
При травмах головного мозга и повреждениях мозжечка, среднего мозга и ствола мозга наблюдается изменение тонуса мышц, что проявляется нарушениями рефлексов, чувствительности и движений.
Спастичность языка
Спастичность языка подразумевает нарушение тонуса мускулатуры не только самого языка, но также и лица, шеи, губ. В данном случае у пациентов язык оттянут назад, его спинка изогнута и приподнята вверх, кончик языка при этом не выражен. Иногда язык может быть «жалом» вытянут вперед.
Повышение тонуса круговой мышцы рта приводит к плотному смыканию губ, либо, напротив, рот может быть приоткрыт. Во втором случае также наблюдается повышенное слюнотечение.
Доктора Юсуповской больницы оказывают медицинскую помощь пациентам при любой тяжести заболевания. В больнице применяют современные инновационные методы терапии, позволяющие сгладить симптоматику патологии и во многих случаях вовсе избавить пациентов от недуга.
Шкала спастичности Ашфорта
«Жесткость» мышц или спастичность, опытный врач может без труда определить во время осмотра.
Если доктор легко может согнуть и разогнуть ногу или руку пациента, то все показатели эластичности и степени напряженности мышц в норме.
Если врач ощущает мышечное сопротивление, то имеет место, повышенный мышечный тонус. Его оценку проводят по шкале спастичности Ашфорта, имеющей следующую структуру:
- 0 — повышения мышечного тонуса нет
- 1 — легкое повышение тонуса, проявляющееся в начальном напряжении мышц и быстром последующем облегчении
- 1а — легкое повышение тонуса, проявляющееся напряжением мышцы меньше, чем в ½ всего объема пассивных движений
- 2 — умеренное повышение мышечного тонуса. При этом напряжение проявляется меньше, чем в ½ всего объема пассивных движений
- 3 — значительное повышение тонуса мышц, сопровождающееся затруднёнными пассивными движениями
- 4 — паретичная часть конечности полностью не сгибается и не разгибается.
Каким бы ни был показатель спастичности мышц, доктора Юсуповской больницы помогут каждому пациенту снизить или вовсе избавиться от подобной симптоматики и улучшить качество их жизни.
Запишитесь на прием к врачам Юсуповской больницы.
Спастичность: причины, симптомы и лечение
Спастичность или гипертонус мышц как синдром сигнализирует о прогрессировании заболеваний ЦНС. Она может возникать у людей преклонного возраста в ответ на гибель двигательных нейронов или как последствие перенесенного инсульта головного мозга, спинального инсульта, травмы головы или позвоночника. Разная выраженность спазмов может как вовсе не мешать жизни пациента, так и приводить к инвалидизации. Примечательно, что на начальных этапах реабилитации после инсульта, спастичность мышц говорит о возможности полного восстановления двигательной активности конечностей.
Факторы возникновения спастичности
Незначительно выраженные судороги и спазмы часто диагностируются у пожилых в связи с возрастными изменениями в нервной регуляции мышц, сухожилий.
Также этому способствуют ношение тесной обуви и одежды, частые переохлаждения, наличие вредных привычек, избыточный вес, постоянные стрессы, некоторые хронические заболевания.
Так как нейродегенеративные болезни развиваются у генетически предрасположенных пациентов, то спастика мышц, развивающаяся из-за патологий ЦНС, тоже может рассматриваться как синдром, передающийся по наследству. Кроме того, спастичность возникает на фоне таких заболеваний:
Часто мышечная спастичность развивается на фоне болезни Паркинсона, Альцгеймера, старческой деменции. Судороги и повышенный тонус мышц могут быть спровоцированы любыми воспалительными заболеваниями, запорами, инфекциями мочеполовой системы.
Симптомы спастичности у пожилых
Первое, на что обращает внимание специалист при диагностике спастичности – повышенный тонус мышц.
При этом больной жалуется на спонтанные судороги, особенно в ночное время и после физической нагрузки, боль при сгибании/разгибании конечности. Также наблюдаются деформации в суставах, изменяется осанка. Повышается рефлекторный ответ.
Патология усугубляется сопутствующими воспалительными процессами в суставах, происходит повышение интенсивности болевых ощущений.
Диагностика и лечение спастичности у пожилых
При неврологической оценке выраженности патологии используется шкала Эшуорта. В ней разделение по степени тяжести заболевания происходит по выраженности гипертонуса мышц.
Максимальная степень поражения – 4, при которой исследуемая конечность практически не сгибается/не разгибается.
С помощью КТ или МРТ определяют наличие каких-либо расстройств в работе ЦНС, повреждений позвоночника, способных вызвать появление спастичности.
Лечение консервативное, комплексное, включает в себя как применение лекарственных средств, так и физиотерапию.
Самолечение противопоказано, все препараты, используемые для терапии спастичности, отпускаются по рецепту врача.
Их действие направлено на снижение тонуса мышц путем угнетения промежуточных нейронов и блокирования нервных импульсов. Передозировка приводит к галлюцинациям, остановке дыхания, летальному исходу.
Для снятия боли могут использоваться местные обезболивающие. Судороги купируются препаратами магния. Обязателен прием витаминов группы В для улучшения работы нейронов, активизации трофики и кровообращения, снятия воспаления.
Физиотерапия заключается в использовании электрофореза, акупунктуры, лечебного массажа, ЛФК. Препочтительнее,чтобы лечение и реабилитация пациента проводились в специализированных медицинских центрах, под наблюдением опытных врачей.
При травмах, опухолях, деформирующих изменениях в суставах может потребоваться хирургическое вмешательство. Операция заключается в усечении нервных корешков, провоцирующих гипертонус мышц. Для лечения легкой и средней степени спастичности у людей пожилого и старческого возраста оперативное вмешательство не рекомендовано.
Спастика – что это такое? Как и зачем с ней бороться?
Спастика или спастический синдром – это болезненные судороги, которые могут появляться после травм или инсультов. Это явление может играть и положительную, и отрицательную роль. Чтобы вернуться к нормальной жизни и снова комфортно передвигаться, нужно с самого начала реабилитации предпринять меры против усиления спастики.
В результате перенесенных инсультов или травм у пациентов могут наблюдаться судороги и спазмы мышц. Например, травма позвоночника может привести к судорогам в ногах, руках, шейном отделе. Обычно спазмы проявляют себя ночью, но нередко затрудняют жизнь и в дневное время. Эти непроизвольные сокращения мышц и называются спастикой или спастическим синдромом.
Что такое спастика простыми словами?
В нормальном состоянии механизм сокращения и расслабления мышц доведен до автоматизма. Все процессы работают безупречно благодаря слаженной работе конечностей, спинного мозга и головного мозга.
Но инсульт или травма приводят к гибели клеток, которые отвечают за передачу сигналов двигательным нейронам спинного и головного мозга.
В итоге тормозящие импульсы не доходят до адресата – координация нарушается.
Другими словами, мышцы ног или рук потеряли связь с мозгом, но при этом они продолжают накапливать энергию. Но эта энергия обязательно должна быть израсходована – это и происходит в виде болезненных судорог. Поскольку прямых команд от мозга мышцы не воспринимают, спазмы могут произойти в любую минуту.
Спастика: хорошо или плохо?
Механизмы формирования спастического синдрома до сих пор недостаточно изучены из-за своей сложности и многогранности. Спастика проявляется не у всех. И в ее наличии, и в ее отсутствии есть свои плюсы и минусы.
Спастика удерживает мышцы в тонусе и способствует их хорошему кровоснабжению. Многие врачи очень положительно оценивают спастику – это означает, что ноги или руки все еще можно восстановить, и человек снова сможет ходить.
Даже несмотря на болевые ощущения, многие пациенты с радостью воспринимают, что их ноги (или руки) «работают», хоть и самопроизвольно. По крайней мере, на первом этапе реабилитации роль спастики является однозначно положительной.
Но в дальнейшем усиление спастического синдрома приводит к серьезным сложностям в восстановлении.
Как не запустить спастику?
Если в первые недели реабилитации предпринять необходимые меры против усиления спастики, то можно снизить возможные негативные последствия. По крайней мере, удастся добиться такого состояния, чтобы комфортно передвигаться и жить нормальной жизнью. Для этого нужно:
- Сократить время в сидячем положении. Конечно, сидеть нужно обязательно, в том числе и для укрепления мышц спины. Вот только нельзя слишком много времени проводить в сидячем положении – это приводит к сокращению и стягиванию (а значит и к потере эластичности) паховых и брюшных мышц, сухожилий.
- Лежать с валиком под грудью. Какое-то время пациент провел сидя, и теперь ему нужно лечь, подложив валик под грудную клетку. Подойдет и обычная подушка. Это нужно, чтобы растянуть мышцы после сокращения. Кроме того, полезно будет при этом положить небольшой груз на копчик (до 5-8 кг, подбирается индивидуально). Дополнительно можно подложить валик (или подушку) чуть выше колена.
- Не лежать на боку с согнутыми ногами. По сути, тот же вред, что и у сидячего положения. Если для пациента эта поза удобна, то, конечно, нельзя от нее отказываться. Нужно ввести себе обязательное правило: каждый раз после этого нужно лежать на животе с подушкой или валиком под грудью.
- Не накачивать мышцы вначале восстановления. На старте реабилитации хочется сделать как можно больше для ускорения восстановления. Но такой подход таит в себе серьезные риски. Из-за спастики мышцы и так забиты, а тренировка только усугубляет ситуацию. Путь тормозных импульсов к адресату становится еще более трудным из-за сильной забитости мышц.
Методы лечения
Полностью избавиться от спастического синдрома не удастся, но можно сделать так, чтобы судороги как можно меньше тревожили и не мешали в обычной жизни. Существует несколько направлений лечения:
- Лечебная физкультура (ЛФК). По сути, единственный действительно эффективный метод борьбы со спастикой, который дает устойчивый результат. Нужно регулярно выполнять комплекс упражнений на растяжку мышц: разминать пальцы ног, делать круговые вращения стопами, выпрямлять и сгибать ноги в сидячем положении, делать наклоны туловища, поочередно поднимать ноги, сгибать ног в коленях в положении на животе. Для ЛФК можно и нужно использовать различный вспомогательный инвентарь: мячи, скамейки, штурвалы для рук, различные тренажеры и другие полезные приспособления.
- Хирургические процедуры. Существует временное решение, которое могут предложить хирурги – подрезание сухожилий. На некоторое время спастический синдром действительно пропадает, но затем возвращается и становится еще более сильным. Не спешите соглашаться на эту операцию, пока не взвесите все за и против.
- Таблетки или уколы. Медицинские препараты способны утихомирить болезненные судороги. Но длительность действия лекарств обычно не превышает 2-3 часов, а после продолжительного приема препараты и вовсе станут неэффективны. К тому же из-за лекарств спастические проявления могут стать более сильными и интенсивными.
ЛФК и лежание на животе с подушкой под грудь – это самые простые и одновременно самые эффективные средства против усиления спастики. У такого лечения нет побочных эффектов и рисков.
К тому же если человек с инвалидностью сам покупает технические средства реабилитации, то можно получить от государства компенсацию их стоимости через социальные службы.
Подробную информацию вы можете уточнить у наших консультантов.
Лечение постинсультной спастичности
Статьи
Парфенов В.А. Московская медицинская академия им. И.М. Сеченова
Актуальность проблемы
В России ежегодно регистрируется 300-400 тысяч инсультов, что приводит к наличию более одного миллиона больных, перенесших инсульт. Более чем у половины из них остаются двигательные нарушения, вследствие которых существенно снижается качество жизни и нередко развивается стойкая инвалидность (1).
Двигательные нарушения после перенесенного инсульта чаще всего проявляются гемипарезом или монопарезом конечности с повышением мышечного тонуса по типу спастичности (1,2,9).
У больных инсультом спастичность обычно нарастает в паретичных конечностях в течение нескольких недель и месяцев, сравнительно редко (чаще всего при восстановлении двигательных) функций наблюдается спонтанное уменьшение спастичности.
Во многих случаях у больных инсультом спастичность ухудшает двигательные функции, способствует развитию контрактуры и деформации конечности, затрудняет уход за обездвиженным больным и иногда сопровождается болезненными мышечными спазмами (2,5,6,9,14).
Восстановление утраченных двигательных функций максимально в течение двух-трёх месяцев с момента инсульта, в дальнейшем темпы восстановления снижаются значительно.
Через год после развития инсульта мало вероятно уменьшение степени пареза, однако возможно улучшение двигательных функций и уменьшение инвалидности путём тренировки равновесия и ходьбы, использования специальных приспособлений для передвижения и снижения спастичности в паретичных конечностях (1,2,6,9,14)
Основная цель лечения постинсультной спастичности состоит в улучшении функциональных возможностей паретичных конечностей, ходьбы, самообслуживания больных.
К сожалению, в значительной части случаев возможности лечения спастичности ограничиваются только уменьшением боли и дискомфорта, связанного с высоким мышечным тонусом, облегчением ухода за парализованным пациентом или устранением имеющегося косметического дефекта, вызванного спастичностью (2,6,14).
Один из наиболее важных вопросов, который приходится решать при ведении больного с постинсультной спастичностью сводится к следующему: ухудшает или нет спастичность функциональные возможности больного? В целом, функциональные возможности конечности у больного с постинсультным парезом конечности хуже при наличии выраженной спастичности, чем при её лёгкой степени. Вместе с тем у части больных при выраженной степени пареза спастичность в мышцах ноги может облегчать стояние и ходьбу, а её снижение привести к ухудшению двигательной функции и даже к падениям (2,6,14).
Перед тем, как начать лечить постинсультную спастичность, необходимо определить возможности лечения у конкретного больного (улучшение двигательных функций, уменьшение болезненных спазмов, облегчение ухода за пациентом и др.) и обсудить их с больным и (или) его родственниками.
Возможности лечения во многом определяются сроками с момента заболевания и степенью пареза, наличием когнитивных расстройств (2,6,14).
Чем меньше сроки с момента развития инсульта, вызвавшего спастический парез, тем более вероятно улучшение от лечения спастичности, потому что оно может привести к существенному улучшению двигательных функций, предотвратив формирование контрактур и повысив эффективность реабилитации в период максимальной пластичности центральной нервной системы.
При длительном сроке заболевания менее вероятно существенное улучшение двигательных функций, однако можно значительно облегчить уход за больным и снять дискомфорт, вызванный спастичностью. Чем меньше степень пареза в конечности, тем более вероятно, что лечение спастичности улучшит двигательные функции (14).
- Лечебная гимнастика
- Лечебная гимнастика представляет наиболее эффективное направление ведения больного с постинсультным спастическим гемипарезом, она направлена на тренировку движений в паретичных конечностях и предотвращение контрактур (2,14).
- В качестве методов физиотерапии используются лечение положением, обучение пациентов стоянию, сидению, ходьбе (с помощью дополнительных средств и самостоятельно), бинтование конечности, применение ортопедических аппаратов, тепловые воздействия на спастичные мышцы, а также электрическая стимуляция определенных мышечных групп, например разгибателей пальцев кисти или передней большеберцовой мышцы (4).
- Больным, имеющим выраженную спастичность в сгибателях верхних конечностей, не следует рекомендовать интенсивные упражнения, которые могут значительно усилить мышечный тонус, например, сжимание резинового кольца или мяча, использование экспандера для развития сгибательных движений в локтевом суставе.
- Массаж мышц паретичных конечностей, имеющих высокий мышечный тонус, возможен только в виде легкого поглаживания, напротив, в мышцах антогонистах, можно использовать растирание и неглубокое разминание в более быстром темпе.
- Иглорефлексотерапия относительно часто используется в нашей стране в комплексной терапии больных, имеющих постинсультный спастический гемипарез, однако контролируемые исследования, проведенные за рубежом, не показывают существенной эффективности этого метода лечения (10).
- Миорелаксанты
В качестве лекарственных средств, принимаемых внутрь для лечения постинсультной спастичности, в клинической практике используются преимущественно баклофен и тизанидин (5-7).
Применяемые внутрь антиспастические средства, уменьшая мышечный тонус, могут улучшить двигательные функции, облегчить уход за обездвиженным пациентом, снять болезненные мышечные спазмы, усилить действие лечебной физкультуры и вследствие этого предупредить развитие контрактур.
При легкой степени спастичности применение миорелаксантов может привести к значительному положительному эффекту, однако при выраженной спастичности могут потребоваться большие дозы миорелаксантов, применение которых нередко вызывает нежелательные побочные эффекты (2,5-7,14).
Лечение миорелаксантами начинают с минимальной дозы, затем её медленно повышают для достижения эффекта. Антиспастические средства обычно не комбинируют.
- Баклофен (Баклосан) оказывает антиспастическое действие преимущественно на спинальном уровне.
- Препарат представляет аналог гамма-аминомасляной кислоты (ГАМК); он связывается с пресинаптическими ГАМК-рецепторами, приводя к уменьшению выделению возбуждающих аминокислот (глутамата, аспартата) и подавлению моно- и полисинаптической активности на спинальном уровне, что и вызывает снижение спастичности.
- За свою долгую историю остается препаратом выбора в лечении спастичности спинального и церебрального происхождения.
Баклофен оказывает также центральное анальгезирующее действие и оказывает противотревожный эффект. Он хорошо всасывается из желудочно-кишечного тракта, максимальная концентрация в крови достигается через 2-3 часа после приёма.
Баклофен (баклосан) используется при спинальной (спинальная травма, рассеянный склероз) и церебральной спастичности; он эффективен при болезненных мышечных спазмах различного генеза.
Баклофен (Баклосан) Начальная доза составляет 5-15 мг в сутки (в один или три приёма), затем дозу увеличивают на 5 мг каждый день до получения желаемого эффекта, препарат принимают во время еды. Максимальная доза баклофена (баклосана) для взрослых составляет 60-75 мг в сутки.
Побочные эффекты проявляются сонливостью, головокружением в начале лечения, хотя они имеют четко дозозависимый характер и в дальнейшем могут ослабевать. Иногда возникают тошнота, запор, диарея, артериальная гипотония.
Баклофен можно использоваться интратекально с помощью специальной помпы при спастичности, вызванной различными неврологическими заболеваниями, включая последствия инсульта (8,11,13).
Использование баклофеновой помпы в сочетании с лечебной гимнастикой, физиотерапией может улучшить скорость и качество ходьбы у больных с постинсультной спастичностью, способных к самостоятельному передвижению (8).
Имеющийся 15-летний клинический опыт применения баклофена интратекально у больных, перенесших инсульт, свидетельствует о высокой эффективности этого метода в уменьшении не только степени спастичности, но и болевых синдромов и дистонических расстройств (13). Отмечено положительное влияние баклофеновой помпы на качество жизни больных, перенесших инсульт (11).
Тизанидин – миорелаксант центрального действия, агонист альфа-2 адренергических рецепторов. Препарат снижает спастичность вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот и активацией глицина, снижающего возбудимость интернейронов спинного мозга.
Препарат обладает также умеренным центральным анальгезирующим действием, эффективен при церебральной и спинальной спастичности, а также при болезненных мышечных спазмах. Начальная доза препарата составляет 2-6 мг в сутки в один или три приёма, средняя терапевтическая доза – 12-24 мг в сутки, максимальная доза – 36 мг в сутки. В качестве побочных эффектов могут отмечаться выраженная сонливость, сухость во рту, головокружение и незначительное снижение артериального давления.
Ботулинический токсин
У больных, перенесших инсульт и имеющих локальную спастичность в паретичных мышцах, можно использовать ботулинический токсин типа А или ботулотоксин (ботокс, диспорт).
Использование ботулинического токсина показано, если у больного, перенесшего инсульт, имеется мышца с повышенным тонусом без контрактуры, а также отмечаются боль, мышечные спазмы, снижение объёма движений и нарушение двигательной функции, связанные со спастичностью этой мышцы (2-4,12,14).
Действие ботулинического токсина при внутримышечном введении вызвано блокированием нервно-мышечной передачи, обусловленным подавлением высвобождения нейромедиатора ацетилхолина в синаптическую щель.
Клинический эффект после инъекции ботулинического токсина отмечается спустя несколько дней и сохраняется в течение 2-6 месяцев, после чего может потребоваться повторная инъекция. Лучшие результаты отмечаются при использовании ботулинического токсина в ранние сроки (до года) с момента заболевания и легкой степени пареза конечности.
Применение ботулинического токсина может быть особенно эффективно в тех случаях, когда имеется эквино-варусная деформация стопы, вызванная спастичностью задней группы мышц голени, или высокий тонус мышц сгибателей запястья и пальцев, ухудшающий двигательную функцию паретичной руки (14).
В контролированных исследованиях доказана эффективность диспорта при лечении постинсультной спастичности в руке (3).
В качестве побочных эффектов от использования ботулотоксина могут быть кожные изменения и боли в месте инъекции. Они обычно самостоятельно регрессируют в течение нескольких дней после инъекции. Возможна значительная слабость мышцы, в которую введён ботулотоксин, а также слабость в мышцах, расположенных близко к месту инъекции, локальная вегетативная дисфункция.
Однако мышечная слабость обычно компенсируется деятельностью агонистов и не приводит к ослаблению двигательной функции. Повторные инъекции ботулотоксина у части больных дают менее значительный эффект, что связывается с образованием антител к ботулотоксину и блокированием его действия.
Ограничение широкого применения ботулинического токсина в клинической практике во многом вызвано его высокой стоимостью.
Хирургические методы лечения
Хирургические операции для уменьшения спастичности возможны на четырёх уровнях — на головном мозге, спинном мозге, периферических нервах и мышцах (2,14). У больных с постинсультной спастичностью они используются редко. Эти методы чаще применяются при детском церебральном параличе и спинальной спастичности, вызванной спинальной травмой.
Хирургические операции на головном мозге включают электрокоагуляцию бледного шара, вентролатерального ядра таламуса или мозжечка и имплантацию стимулятора на поверхность мозжечка. Эти операции используются редко и имеют определённый риск осложнений.
На спинном мозге может быть проведено продольное рассечение конуса (продольная миелотомия) с целью разрыва рефлекторной дуги между передними и задними рогами спинного мозга. Операция применяется при спастичности нижних конечностей, она технически сложна и связана с высоким риском осложнений, поэтому используется редко.
Шейная задняя ризотомия может привести к снижению спастичности не только в верхних конечностях, но и в нижних, однако выполняется редко из-за риска осложнений.
Селективная задняя ризотомия представляет наиболее частое вмешательства среди операций на спинном мозге и его корешках, она обычно используется при спастичности в нижних конечностях на уровне от второго поясничного до второго крестцового корешка.
Рассечение периферических нервов может устранить спастичность, однако эта операция нередко осложняется развитием болей, дизестезий и нередко требует дополнительной ортопедической операции, поэтому используется редко.
Значительная часть хирургических операций у пациентов со спастичностью различного генеза проводится на мышцах или их сухожилиях.
Удлинение сухожилия мышцы или перемещение мышцы уменьшает активность интрафузальных мышечных волокон, снижая тем самым спастичность. Эффект от операции сложно прогнозировать, иногда требуется несколько операций.
При развитии контрактуры хирургическое вмешательство на мышцах или их сухожилиях нередко представляет единственный метод лечения спастичности.
Заключение
Лечение постинсультной спастичности представляет актуальную проблему современной неврологии. Ведущую роль в лечении постинсультной спастичности имеет лечебная гимнастика, которая должна начинаться уже с первых дней развития инсульта и быть направлена на тренировку утраченных движений, самостоятельное стояние и ходьбу, а также профилактику развития контрактур в паретичных конечностей.
В тех случаях, когда у больного с постинсультным парезом конечности имеется локальная спастичность, вызывающая ухудшение двигательных функций, можно использовать локальное введение препаратов ботулинического токсина.
В качестве лекарственных антиспастических средств, применяемых внутрь, рекомендуются Баклофен (Баклосан) и тизанидин, которые способны уменьшить повышенный тонус, облегчить физиотерапевтические занятия, а также уход за парализованным больным. Одним из перспективных методов лечения посинсультной спастичности является введение баклофена интратекально с помощью специальной помпы, эффективность которого активно изучается в последние годы.
ЛИТЕРАТУРА 1. Дамулин И.В., Парфенов В.А., Скоромец А.А., Яхно Н.Н. Нарушения кровообращения в головном и спинном мозге. В кн.: Болезни нервной системы. Руководство для врачей. Под ред. Н.Н. Яхно. М.: Медицина, 2005, Т.1., С. 232-303. 2. Парфенов В.А.. Спастичность В кн.
: Применение ботокса (токсина ботулизма типа А) в клинической практике: руководство для врачей / Под ред. О.Р. Орловой, Н.Н. Яхно. – М.: Каталог, 2001 – С. 91-122. 3. Bakheit A.M., Thilmann A.F., Ward A.B. et al.
A randomized, double-blind, placebo-controlled, dose-ranging study to compare the efficacy and safety of three doses of botulinum toxin type A (Dysport) with placebo in upper limb spasticity after stroke // Stroke. – 2000. – Vol. 31. – P. 2402-2406. 4. Bayram S., Sivrioglu K., Karli N. Et al.
Low-dose botulinum toxin with short-term electrical stimulation in poststroke spastic drop foot: a preliminary study // Am J Phys Med Rehabil. – 2006. — Vol. 85. – P. 75-81. 5. Chou R., Peterson K., Helfand M. Comparative efficacy and safety of skeletal muscle relaxants for spasticity and musculoskeletal conditions: a systematic review. // J Pain Symptom Manage. – 2004.
– Vol. 28. – P.140–175. 6. Gallichio J.E. Pharmacologic management of spasticity following stroke. // Phys Ther 2004. – Vol. 84. – P. 973–981. 7. Gelber D. A., Good D. C., Dromerick A. et al. Open-Label Dose-Titration Safety and Efficacy Study of Tizanidine Hydrochloride in the Treatment of Spasticity Associated With Chronic Stroke // Stroke. – 2001. — Vol.32. – P.
1841-1846. 8. Francisco G.F., Boake C. Improvement in walking speed in poststroke spastic hemiplegia after intrathecal baclofen therapy: a preliminary study // Arch Phys Med Rehabil. – 2003. – Vol. 84. – P. 1194-1199. 9. Formisano R., Pantano P., Buzzi M.G. et al. Late motor recovery is influenced by muscle tone changes after stroke // Arch Phys Med Rehabil. – 2005.
– Vol. 86. – P.308-311. 10. Fink M., Rollnik J.D., Bijak M. Et al. Needle acupuncture in chronic poststroke leg spasticity // Arch Phys Med Rehabil. — 2004. – Vol. 85. – P.667-672. 11. Ivanhoe C.B., Francisco G.E., McGuire J.R. et al. Intrathecal baclofen management of poststroke spastic hypertonia: implications for function and quality of life // Arch Phys Med Rehabil.
– 2006. – Vol. 87. – P. 1509-1515. 12. Ozcakir S., Sivrioglu K. Botulinum toxin in poststroke spasticity // Clin Med Res. – 2007. – Vol. 5. – P.132-138. 13. Taira T., Hori T. Intrathecal baclofen in the treatment of post-stroke central pain, dystonia, and persistent vegetative state // Acta Neurochir Suppl. – 2007. – Vol.97. – P. 227-229.
14. Ward A.B. A summary of spasticity management – a treatment algorithm // Eur. J. Neurol. – 2002. – Vol. 9. – Suppl.1. – P. 48-52.
ДЦП. Часть третья. Коррекция спастики
- Авторы: Островерхова Анна
- (Начало публикации о ДЦП читайте здесь и здесь.)
- В одном из предыдущих материалов я уже писала о высоком мышечном тонусе, массовой гипердиагностике и случаях, когда действительно требуется его коррекция.
Основная мысль там следующая: повышение мышечного тонуса — это компенсация отсутствия движений. Если мозг не может управлять конечностью, то он делает из нее костыль.
В таком случае возникает вопрос: а нужно ли вообще бороться с высоким мышечным тонусом, если его повышение изначально призвано помогать конечностям выполнять свою опорную функцию?
Как выяснилось, действительно не всегда есть резон бороться с повышением тонуса. Бывает так, что при снижении мышечного тонуса на первый план выходит мышечная слабость, и тогда конечность вообще теряет свою опорную функцию.
В этой таблице собраны положительные и отрицательные эффекты спастичности. Как мы видим, эффекты у спастики есть разные. Неблагоприятных, конечно, больше, но и не замечать благоприятные мы не можем. Это значит, что принимать решение о необходимости коррекции мышечного тонуса каждый раз мы будем индивидуально, внимательно и вдумчиво осматривая ребенка, взвешивая все «за» и «против».
Прежде чем заняться коррекцией мышечного тонуса, нужно оценить его максимально точно и объективно. Просто написать, что тонус высокий или низкий — это не написать ничего. Существуют специальные шкалы, которые позволяют выражать в баллах мышечный тонус.
Модифицированная шкала Эшоурта
- Модифицированная шкала оценки мышечного тонуса Тардье
- Измерение амплитуды движений в суставе проводится трижды с разной скоростью:
- В самом медленном темпе (скорость V1) оценивается пассивная амплитуда движения (R2).
- Со скоростью V2 оценивается амплитуда движения в суставе под действием сил тяжести.
- Движение выполняется в быстром темпе (V3), оценивается амплитуда движения R1.
Чем больше разница между R1 и R2, тем выше спастичность в мышце, которая растягивается при выполнении данного движения. Разница амплитуд движения в 30 градусов (измеряется гониометром) является прямым показанием к проведению ботулинотерапии тестируемой мышцы.
Эти шкалы очень важны, т.к. дают возможность принять решение о целесообразности изменения тонуса, наблюдать за изменением тонуса в динамике (до/после лечения), возможна преемственность между специалистами.
Заниматься коррекцией мышечного тонуса мы будем в таких случаях:
- Оценка по модифицированным шкалам Эшуорта и Тардье — от 3 баллов и выше.
- Спастика нарушает походку.
- Спастика вызывает мышечную боль.
- Высок риск формирования контрактур, подвывихов/вывихов в тазобедренных суставах.
- Спастика усугубляет нарушение жизнедеятельности пациента (затрудняет уход за пациентом или его самообслуживание).
Коррекция спастики может осуществляться такими методами:
Пероральные препараты, обычно используемые у детей, это баклофен, диазепам, клоназепам, дантролен и тизанидин.
Эти препараты обладают центральным действием, а значит, они неселективны. Их действие распространяется на все группы мышц: и с высоким тонусом, и с нормальным.
То есть снижение тонуса будет сопровождаться слабостью даже в здоровых конечностях. Также за счет центрального действия миорелаксанты приводят к седации и снижению познавательных процессов.
Поэтому есть рекомендации относительно комбинации данных препаратов для усиления эффекта и уменьшения побочного действия.
Большинство исследований эффективности этих препаратов старые и проводились не по принципам доказательной медицины. Поэтому на сегодняшний день миорелаксанты не входят в современные рекомендации по управлению спастикой.
Ботулинотерапия — это эффективный и безопасный метод управления спастикой с уровнем доказательности А.
Надо помнить, что само по себе снижение мышечного тонуса никак не влияет на приобретение ребенком новых навыков, но чисто технически дает возможность провести качественно физическую реабилитацию.
- Интратекальное введение баклофена.
Введение баклофена в спинномозговой канал было одобрено для лечения спастичности в 1996 году. Баклофеновая помпа представляет собой хирургическую имплантированную систему, используемую для контроля спастичности путем введения баклофена непосредственно в спинной канал и вокруг спинного мозга.
Так как баклофен распространяется на всем протяжении позвоночного канала, то и тонус снижается во всех конечностях, их опорная функция на фоне высокой слабости пропадает, поэтому этот вид снижения тонуса подходит только для детей, которые самостоятельно не передвигаются, — для облегчения родителям ухода за ними, предотвращения ортопедических осложнений и болевого синдрома.
- Селективная дорзальная ризотомия.
- Данная нейрохирургическая операция выполняется при выраженной спастике.
- Пересечение определенной порции дорзальных (чувствительных) корешков чаще всего выполняется на пояснично-крестцовом уровне при спастическом параличе нижних конечностей с частичным сохранением произвольных движений и существенной ограничивающей ролью спастики в реализации этих движений.
- Есть мнение, что это идеальный метод управления спастикой детей с 4–5 уровнем крупной моторики по GMFCS.
- Всем хорошего тонуса!
С уважением, невролог Островерхова А. М.
- Источник, в котором вы найдете больше ссылок на исследования
Спастичность: от патофизиологии к лечению
cпастичность — важнейшая составляющая синдрома поражения верхнего двигательного нейрона, которая выявляется более чем у 12 млн больных в мире и по разным данным, является причиной инвалидизации 12—27% из них [1, 2].
Перечень нозологических форм, при которых в структуре синдрома поражения верхнего мотонейрона (ПВМ) наблюдается спастический гипертонус, значителен.
Он определяется примерно у 20—40% выживших после инсульта, у 65—78% пациентов с поражениями спинного мозга и у 85% больных рассеянным склерозом [3—5].
Интерес к этиопатогенезу, клинике, диагностике и лечению спастичности проявлялся со времени формирования неврологии, но особенно интенсивно спастичность изучается в последнее десятилетие, когда этот симптомокомплекс стал оцениваться в контексте нейропластичности.
Определенный прорыв, сделанный в последние годы в понимании роли и места спастичности в структуре ПВМ, тем не менее оставляет открытым ряд вопросов по этой проблеме.
В последние десятилетия сам термин «спастичность» является предметом постоянных дискуссий. С 1980 г. наиболее цитируемым было определение J.
Lance [6]: «Спастичность — это моторное расстройство, характеризующееся зависимым от скорости увеличением тонических рефлексов растяжения (мышечного тонуса) с повышенными сухожильными рефлексами вследствие гипервозбудимости рефлекса растяжения как одного из компонентов синдрома верхнего мотонейрона». Однако в последние годы положения этой дефиниции начали все больше оспариваться и уточняться.
Неудовлетворенность научного сообщества определением J. Lance спастичности вполне объяснима.
Во-первых, спастичность зависит не только от скорости растяжения мышцы, но и от ее длины. У части мышц (флексоры верхних конечностей, трехглавая мышца голени) тонус выше в удлиненном состоянии, у других (квадрицепс бедра) — в укороченном положении [7—9].
С последним обстоятельством может быть связан феномен «складного ножа», хотя интерпретация этого симптома не столь очевидна, поскольку он также обусловлен возбуждением высокопороговых мышечных рецепторов (группы III и IV) афферентов флексорного рефлекса [10].
Во-вторых, в определении декларируется, что у пациентов со спастичностью прослеживается линейная зависимость между активностью мышцы и скоростью ее растяжения.
Так, при медленном растяжении и малой его амплитуде повышение тонуса может вообще не определяться.
Однако известно, что мышечная активность при спастичности определяется не только во время быстрого растяжения (динамическая фаза), но и в течение некоторого времени после него (статическая фаза) (рис. 1).
Рис. 1. ЭМГ-активность лучевого сгибателя кисти до и после растяжения мышцы на угол 60° у пациента со спастичностью после инсульта.
Следовательно, понятие «спастичность» должно также включать понятие «изометрическое сокращение мышцы после ее растяжения» [11].
Во-третьих, сочетание гиперрефлексии и гипертонуса, упомянутое в определении, корреспондирует с опытами Ч. Шеррингтона (1896) на децеребрированных животных и опосредовано денервированными спинальными нейронами.
Следуя этой логике, ряд авторов [12, 13] предлагают более широкую трактовку определения спастичности с расширением списка сопутствующих мышечному гипертонусу «спинальных» симптомов за счет клонусов, спазмов, миостатических флексорных рефлексов и т. д.
Вышеперечисленные клинические признаки не являются облигатными в симптомокомплексе спастичности, могут существовать независимо друг от друга и иметь разные механизмы происхождения.
Возникают вопросы и сомнения в отношении спастичности как феномена, имеющего сочетанное или сходное происхождение с прочими проявлениями ПВМ (гиперрефлексия, мышечная слабость и патологические пирамидные знаки). Неуверенность в адекватности определения J.
Lance [6] и в обоснованности современного понимания спастичности приводит к перманентным попыткам дать более удачное определение.
Так, например, по определению группы EU-SPASM (Thematic Network to Develop Standardised Measures of Spasticity, 2006), спастичность — это нарушение сенсомоторного контроля из-за ПВМ, проявляющееся перемежающейся или длительной непроизвольной активацией мышц [14].
Пластические модификации при спастичности происходят как на спинальном, так и на супраспинальном уровнях.
Отражением структурно-функциональных перестроек является клиническая симптоматика, которая при ПВМ любого происхождения реализуется стереотипно и проходит несколько стадий: 1 — мышечная слабость (парез); 2 — появление спастичности; 3 — повышение спастичности с синергичными произвольными движениями; 4 — уменьшение моторных паттернов спастичности с синергичными произвольными движениями; 5 — появление более сложных движений при продолжающемся снижении спастичности; 6 — исчезновение спастичности; 7 — полное восстановление нормальной функции с координированными произвольными движениями.
Этот процесс всегда осуществляется последовательно, проходя все описанные стадии с разной скоростью или замирая на каком-либо этапе [15, 16]. Часть из этих процессов не вполне объяснима.
Например, не известно, чем вызваны появление и стихание синергий и спастичности, чем обусловлены эти проявления, насколько они облигатны, где лежат области их инициации и элементом какого процесса является спастичность — пато- или саногенеза?
Известно, что центральная регуляция произвольных движений и мышечного тонуса опосредована гетерогенными патофизиологическими механизмами [17].
Отчасти это подтверждается результатами применения селективных ингибиторов обратного захвата серотонина или антагонистов серотонина у пациентов с ПВМ, которые приводят к изменению выраженности спастичности, но никак не влияют на мышечную силу [18, 19].
Приведенный тезис позволяет в некоторой степени упрощенно рассматривать процессы пластических модификаций при ПВМ как состоящие из трех стадий: мышечной слабости, спастичности (возникновение, повышение, уменьшение: стадия 2—5), восстановление (произвольный двигательный контроль без спастичности: стадия 6—7).
В остром периоде повреждения головного мозга у пациентов, помимо парезов и параличей, могут наблюдаться гипотонус, снижение глубоких рефлексов (негативные признаки ПВМ), а также иногда симптом Бабинского.
Второй этап дебютирует между 1-й и 6-й неделями поражения мозга и характеризуется: спастичностью, повышением глубоких рефлексов, клонусами, экстензорными или флексорными сокращениями, синкинезиями, коконтракциями, спастической дистонией (позитивные признаки ПВМ).
Задержка в появлении этих симптомов, вероятно, обусловлена временем, необходимым для реализации пластической реорганизации мозговых структур.
Спастичность на этой стадии развивается постепенно и исходно может выступать проявлением приспособительных реакций к снижению силы в мышцах конечностей (контракция отдельных мышц), а затем она отражает аномальные пластические модификации, значительно замедляя процесс восстановления произвольных движений (например, поза Вернике—Манна как устойчивая форма приспособления паретичной конечности к акту ходьбы) [17].
Супраспинальный контроль мышечного тонуса опосредован дорзальным и медиальным ретикулоспинальными трактами, а также вестибулоспинальным трактом (играет второстепенную роль).
Первый из них начинается из вентромедиальных ядер ретикулярной формации продолговатого мозга, получающих облегчающие импульсы из премоторной коры, и оказывает тормозное влияние на рефлекс растяжения (стретч-рефлекс). Его поражение, как и патология премоторных кортиконуклеарных эфферентов, приводит к развитию спастичности.
Медиальный ретикулоспинальный и вестибулоспинальный тракты берут свое начало из дорзальных ядер ретикулярной формации и вестибулярных ядер, не находящихся под корковым контролем. Они оказывают возбуждающее действие на рефлекс растяжения (рис. 2)
Рис. 2. Супраспинальная регуляция стретч-рефлекса (адаптировано по С. Trompetto и соавт. [11]). и, соответственно, их повреждение уменьшает стретч-рефлекс [11].
Таким образом, можно предполагать, что специфическая клиническая картина ПВМ при церебральной патологии обусловлена сочетанным поражением пирамидных трактов и кортикобульбарных путей к вентромедиальным ядрам ретикулярной формации и красному ядру. Тем не менее это не объясняет вариативность картины спастичности, когда наблюдаются противоположные паттерны, в том числе в пределах одной нозологии.
При спинальной патологии аналогичный симптомокомплекс может наблюдаться при изолированном поражении бокового канатика, где дорзальный ретикулоспинальный и латеральный кортикоспинальный тракты проходят близко друг от друга.
Патология спинного мозга с вовлечением в процесс боковых и передних (медиальный ретикулоспинальный и вестибулоспинальный тракты) канатиков ведет к утрате не только тормозных, но и облегчающих влияний на рефлекс растяжения.
Однако, поскольку оба тракта ингибируют ноцицептивный флексорный рефлекс (рефлекс отдергивания), то в клинической симптоматике у этих пациентов преобладает флексорная спастичность [20].
При ПВМ любой этиологии вышеобозначенным нарушениям супраспинальной регуляции мышечного тонуса сопутствует снижение мышечной силы, регулируемой кортикоспинальным трактом. Блокада надсегментарных влияний и денервация α-мотонейронов запускают базисный процесс перестройки работы сегментарного аппарата.
Развивается гипервозбудимость клеточных мембран α-мотонейронов, синаптические связи с денервированными интернейронами претерпевают морфологические изменения, меняется обработка афферентного сигнала к α-мотонейронам (при нормальном функционировании мышечных веретен, регулируемых γ-клетками) [21].
Эти факторы и ингибиторные влияния на мембрану напрямую влияют на выраженность стретч-рефлекса в динамическую фазу растяжения. Избыточность афферентации по Iа-волокнам возникает вследствие нарушения процессов пре- и постсинаптического торможения.
Снижение пресинаптической ингибиции Iа-афферентных терминалей реализуется через ГАМКергические синапсы по механизму аксо-аксонального взаимодействия [22, 23].
Уменьшение постсинаптического торможения происходит из-за нарушения ингибиторных влияний рецепторов Гольджи (аутогенное торможение), клеток Реншоу (возвратное торможение), а также мышечных веретен мышц-антагонистов по Iа-волокнам (реципрокное дисинаптическое торможение).
В результате этого избыточная афферентация поступает к α-мотонейронам не только по «скоростьзависимым» Iа-волокнам (преимущественно моносинаптический путь), но и по волокнам II типа (полисинаптический путь), несущим информацию о длине мышцы. Это приводит к повышению мышечной активности и в динамической, и в изометрической (статической) фазе стретч-рефлекса (рис. 3)
Рис. 3. Схема регуляции мышечного тонуса на уровне спинного мозга. [24—28].
При нарушении пирамидного пути возникает преобладание стволовых (или экстрапирамидных) влияний, реализуемых через ретикулоспинальный, вестибулоспинальный, тектоспинальный, руброспинальный тракты. Однако их связи с α-мотонейрональным аппаратом менее избирательны. Это ведет к дискоординации системы управления и чрезмерной активности мышц [29, 30].
Кроме того, считается, что денервированные α-клетки высвобождают факторы роста, что способствует локальному прорастанию аксонов из соседних интернейронов и образованию новых, аномальных синапсов, которые инициируют дисфункциональные спинальные рефлексы [31—33].
Еще одним важным проявлением пластических модификаций на сегментарном уровне является нарушение постактивационной депрессии. Этот феномен не связан со спинальными ингибиторными системами и не контролируется супраспинальными влияниями.
В норме он зависит от внутренних свойств нейронов и проявляется в снижении высвобождения нейротрансмиттеров Iа-терминалями при их повторной активации. При ПВМ интенсивность постактивационной депрессии начинает уменьшаться, коррелируя с тяжестью повреждения и степенью выраженности спастичности [34, 35]. По данным М. Dafotakis и соавт.
[36], кинезиотерапия отчасти нормализует эти нарушения, что клинически проявляется уменьшением спастичности. С учетом того, что мышечная иммобилизация приводит к формированию так называемого «внутреннего или нерефлекторного мышечного гипертонуса» (т.е.
мышечно-сухожильной контрактуры или диффузного мышечного соединительнотканного изменения), ранняя активация пациентов является одним из важнейших путей предотвращения и купирования спастичности.
Эксперименты на животных показывают, что иммобилизация достаточно быстро приводит к уменьшению числа саркомеров и замещению их соединительной тканью, мышечной резистентности к пассивным смещениям, повышению чувствительности к растяжению остаточного пула мышечных веретен [37, 38].
В отличие от постактивационной депрессии и «внутренней мышечной гипертонии» другие вышеобозначенные процессы напрямую зависят от модальности супраспинальных влияний. Таким образом, регресс спастичности зависит от реорганизации и восстановления системы супраспинального управления.
Эти изменения реализуются вблизи очага поражения и на отдалении от него, в ипси- и контралатеральных областях, что выражается в клинической симптоматике на стадиях 4—7 пластической модификации [39—41].
Это либо восстанавливает утраченные функции, либо компенсирует их за счет обретенных при обучении [42].
Реорганизация мозговых структур напрямую зависит от возраста, интенсивности реабилитации и индивидуальной способности к обучению. Она, как правило, достигает своего пика в первые 4 нед после ПВМ и интенсивно продолжается в течение 6 мес [43]. Предполагается, что грамотная интенсивная реабилитация позволяет продлить время пластических перестроек до года и более [44].
Активизация ретикулоспинальных проводников и спастичность в целом — аномальные проявления процесса восстановления движений [45]. Тем не менее можно полагать, что в их основе лежит полезный приспособительный процесс, позволяющий компенсировать мышечную слабость и утрату двигательной и опорной функции.
Так, в острой и подострой стадиях дополнительная афферентная стимуляция ретикулоспинальных проводников является положительным процессом (особенно при выраженных парезах) [46].
Очевидную негативность этот процесс приобретает только в последующий восстановительный период, когда его низкая модальность и мышечная ригидность становятся серьезной проблемой и препятствуеют реабилитации [47].