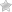Авторы: Петриков А.С. 1, 2 , Дудин Д.В. 1, 3 , Шойхет Я.Н. 1, 3 , Белых В.И. 1 , Простов И.И.
4 1 Ф ГБОУ ВО АГМУ Минздрава России, Барнаул 2 КГБУЗ «Диагностический центр Алтайского края», Барнаул 3 КГБУЗ «Городская больница № 5», Барнаул 4 ФГБОУ ВО РостГМУ Минздрава России, Ростов-на-Дону Цель исследования: изучить реканализацию глубоких вен у больных с перенесенным проксимальным тромбозом на фоне пролонгированной антитромботической терапии (АТТ) варфарином, дабигатрана этексилатом и сулодексидом в течение 1 года. Материал и методы: в исследование включены 210 пациентов. В 1-ю группу включены 68 пациентов, получавших терапию антагонистами витамина К (АВК). 2-ю группу составили 78 больных, которым назначался дабигатрана этексилат после стандартной терапии гепаринами в течение 5 дней. 3-ю группу составили 64 больных, которым после курса стандартной АТТ (гепарины в остром периоде с переходом на АВК) через 3 мес. назначался сулодексид. Ультразвуковое ангиосканирование сосудов венозной системы нижних конечностей выполнялось при госпитализации больного и накануне выписки на 10–14-е сут на фоне АТТ по стандартным общепринятым методикам. В дальнейшем амбулаторно у пациентов в течение 1 года через 1, 3, 6 и 12 мес. от начала рандомизации изучалась реканализация вен на сканерах Envisor C и Acuson Antares (Германия). Результаты исследования: частота встречаемости больных с окклюзионными формами в проксимальном сегменте на фоне продленной терапии варфарином в течение года статистически значимо выше на 20,7% и 18,3% соответственно, чем на фоне приема дабигатрана этексилата и сулодексида. При этом у больных, принимавших дабигатрана этексилат в течение года, не было выявлено ни одного случая остаточных тромботических окклюзий магистральных вен, а на фоне приема сулодексида — лишь у 2,4% больных. Заключение: продленное применение дабигатрана этексилата и сулодексида в течение 1 года у больных с перенесенным проксимальным тромбозом глубоких вен превосходит по безопасности варфарин и сопровождается развитием ранней реканализации в проксимальных сегментах венозного русла.
Ключевые слова: тромбоз, проксимальный тромбоз глубоких вен, реканализация, антитромботическая терапия, варфарин, дабигатрана этексилат, сулодексид.
Для цитирования: Петриков А.С., Дудин Д.В., Шойхет Я.Н. и др. Реканализация проксимального тромбоза глубоких вен на фоне длительной антитромботической терапии. РМЖ. 2019;2:25-30.
Recanalization of deep vein proximal thrombosis against a background of prolonged antiplatelet therapy A.S. Petrikov1,2, D.V. Dudin1,3, Y.N. Shoikhet1,3, V.I. Belykh1, I.I. Prostov4
1Altai State Medical University, Barnaul
2Altai Krai Diagnostic Center, Barnaul 3City hospital No 5, Barnaul 4Rostov State Medical University, Rostov-on-Don
Aim: to study recanalization of deep veins in patients with proximal thrombosis against the background of prolonged antiplatelet therapy (APT) with warfarin, dabigatran etexilate and sulodexide during the year.
Patients and Methods: 210 patients were included in the study. Group 1 includes 68 patients treated with vitamin K antagonists (VKA). Group 2 consisted of 78 patients who were prescribed dabigatran etexilate after standard heparin therapy for 5 days. Group 3 consisted of 64 patients, who were prescribed sulodexide after 3 months after the course of standard ACT (heparin in the acute period with transition to VKA). US-angioscanning of the lower limbs venous system was performed at the hospitalization of the patient and on the eve of discharge for 10–14 days against the background of APT by standard common methods. Later on, outpatients underwent a study of vein recanalization on Envisor C and Acuson Antares scanners (Germany) during a year after 1, 3, 6 and 12 months from the beginning of randomization. Results: the frequency of patients with occlusion forms in the proximal segment against the background of prolonged therapy with warfarin during the year is statistically significantly higher by 20.7% and 18.3%, respectively, than on dabigatran etexilate and sulodexide. At the same time, no cases of residual thrombotic occlusions of the main veins were detected in patients taking dabigatran etexilate during the year, and only in 2.4% of patients taking dabigatran etexilate. Conclusion: prolonged use of dabigatran etexilate and sulodexide for a year in patients with deep vein proximal thrombosis exceeds warfarin safety and is accompanied by the development of early recanalization in the proximal segments of the venous channel.
Keywords: thrombosis, proximal deep vein thrombosis, recanalization, antiplatelet therapy, warfarin, dabigatran etexilate, sulodexide.
For citation: Petrikov A.S., Dudin D.V., Shoikhet Y.N. et al. Recanalization of deep vein proximal thrombosis against a background of prolonged antiplatelet therapy. RMJ. 2019;2:25–30.
В статье представлены результаты исследования, посвященного изучению реканализации глубоких вен у больных с перенесенным проксимальным тромбозом на фоне пролонгированной антитромботической терапии в течение 1 года.
Перенесенный тромбоз глубоких вен (ТГВ) — причина развития посттромботической болезни (ПТБ) у 35–69% больных в течение первых 3 лет и у 49–100% больных в течение первых 5–10 лет [1]. Существенную роль в развитии ПТБ и тяжелых форм хронической венозной недостаточности (ХВН) играет локализация тромбоза. Так, ПТБ может наблюдаться у 98% больных с проксимальным ТГВ, у 46% пациентов с поражением вен голени и бедра, у 25% больных с ТГВ голени [2]. Известно, что у 50% больных с перенесенными венозными тромбозами выше колена развиваются тяжелые трофические нарушения с формированием длительно незаживающих трофических язв в течение первых 2–3 лет [3]. Большое значение при формировании ПТБ после перенесенного ТГВ, особенно илеофеморального сегмента, имеет степень реканализации, что во многом определяет тяжесть формирующейся ХВН [4–6]. Известно, что наиболее активно процесс реканализации после перенесенного острого венозного тромбоза происходит в течение первых 6–12 мес. В дальнейшем динамика морфологических изменений в глубоких венах не столь значима [5]. Установлено, что ранняя реканализация может улучшить результаты лечения ТГВ у отдельных пациентов. В работах последних лет было доказано, что существует прямая взаимосвязь между степенью и временем реканализации глубоких вен нижних конечностей, выраженностью клинической симптоматики ХВН у больных с перенесенным проксимальным тромбозом [7, 8]. В то же время неполная реканализация или ее отсутствие связаны с более высокой частотой формирования ПТБ вследствие ухудшения кровотока и повышения венозного давления. Так, у пациентов с остаточными тромбомассами риск развития ПТБ выше в 6 раз, чем у пациентов с полной реканализацией (отношение шансов 6,0; р=0,006; 95% доверительный интервал: 1,7–21,9) [9]. В последние годы были определены характеристики, повышающие риск развития рецидива венозного тромбоза. Прежде всего это наличие остаточных резидуальных тромбомасс в глубоких венах после прекращения лечения, а также их длина более 9 см (по данным ультразвукового ангиосканирования сосудов (УЗАС)), повышение содержания D-димеров, коагуляционного фактора VIII и IX, а также дефицит антитромбина III, протеина С и S, сокращение активированного парциального тромбопластинового времени (АПТВ), наличие мутации Лейдена (FV) и протромбина (FII), антифосфолипидных антител в крови и гипергомоцистеинемия [10]. Кроме того, установлены факторы риска развития ПТБ: илеофеморальный венозный тромбоз, возраст старше 70 лет, высокий индекс массы тела, рецидивирующий ипсилатеральный тромбоз, неадекватная антикоагулянтная терапия ТГВ, отсутствие приверженности ранней активизации и эластической компрессии, отсутствие попыток ранней тромбэктомии, плохая реканализация глубоких вен (по данным УЗАС) с подъемом D-димеров по истечении 1 мес. после эпизода острого венозного тромбоза, высокий показатель по шкале Villalta после первых проявлений венозного тромбоза и cохраняющаяся обструкция подвздошных вен [11]. При этом даже отдельные факторы могут оказывать существенное влияние на развитие ПТБ. Так, рецидив ипсилатерального острого венозного тромбоза повышает риск развития ПТБ в 1,6–9,6 раза, наличие проксимальной локализации тромбоза — в 1,5–6,3 раза, резидуальной венозной обструкции — в 1,6–2,1 раза; повышенный уровень маркеров воспаления — в 1,4–8,0 раз, зрелый возраст — в 0,6–3,9 раза, наличие ожирения — в 1,1–3,5 раза, исходное хроническое заболевание вен — в 1,5–3,2 раза, неадекватная антикоагулянтная терапия — в 1,8–2,7 раза [12]. В последние годы широкое распространение в клинической практике получили таблетированные антитромботические средства, в частности дабигатрана этексилат, который является пероральным антикоагулянтом и прямым ингибитором тромбина, препятствующим образованию тромба [13], а также гепариноиды, способные корригировать процессы микроциркуляции на тканевом уровне и воздействовать на процессы системы гемостаза. Среди последних большой интерес представляет сулодексид, обладающий антикоагулянтным действием за счет сродства к кофактору II гепарина. Препарат подавляет активированный X-фактор, усиливает синтез и секрецию простациклина (ПГI2) и снижает уровень фибриногена в плазме крови [14]. Однако в настоящее время недостаточно изучены вопросы реканализации глубоких вен нижних конечностей на фоне продленной антитромботической терапии (АТТ). Это является основанием для изучения процессов реканализации в глубоких венах после перенесенного тромбоза в течение 1 года в зависимости от применения антикоагулянтов и антитромботических препаратов, особенно в ситуациях, когда больному невозможно назначить антагонисты витамина К (АВК). Все вышеперечисленное явилось предпосылкой для проведения сравнительного исследования у больных с проксимальным ТГВ нижних конечностей в зависимости от используемой схемы АТТ в отдаленном периоде.
Цель исследования: изучить особенности реканализации глубоких вен у больных с перенесенным проксимальным тромбозом на фоне пролонгированной АТТ варфарином, дабигатрана этексилатом и сулодексидом в течение года.
В сравнительное проспективное исследование были включены 210 больных в возрасте от 18 до 69 лет с острым проксимальным ТГВ, находившихся на лечении в отделении сосудистой хирургии КГБУЗ «Городская больница № 5» (Барнаул) в 2014–2017 гг. В 1-ю группу включены 68 пациентов (38 мужчин и 30 женщин; средний возраст — 46,8±2,1 года), получавших терапию АВК. 2-ю группу составили 78 больных, которым назначался дабигатрана этексилат после стандартной терапии гепаринами в течение 5 дней (41 мужчина и 37 женщин; 51,0±3,1 года). 3-ю группу составили 64 больных (32 мужчины и 32 женщины; 47,0±2,3 года), которым после курса стандартной АТТ (гепарины в остром периоде с переходом на АВК) через 3 мес. назначался сулодексид.
Критериями включения в исследование являлись наличие проксимального ТГВ, документально подтвержденного по УЗАС, возраст от 18 до 69 лет, длительность заболевания не более 7 сут.
Критерии исключения: возраст моложе 18 лет и старше 69 лет, оперативные вмешательства, скелетные травмы и переломы, длительная иммобилизация, онкологические заболевания, острые инфекции, авиаперелеты, противопоказания к АТТ, тяжелые сопутствующие заболевания почек, печени и сердца в стадии декомпенсации, а также прием варфарина на момент госпитализации в связи с наличием нарушений ритма.
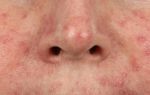
В 1-й группе изолированный проксимальный ТГВ наблюдался у 59 больных (86,8%), во 2-й группе — у 69 (88,5%), а в 3-й группе — у 57 (89,1%) (р>0,05); тогда как сочетание ТГВ с тромбозом поверхностных вен отмечено у 2 больных в каждой из 3 групп. Сочетание проксимального ТГВ и ТЭЛА в 1-й группе отмечено у 7 больных (10,3%), во 2-й группе — у 7 (9,0%), а в 3-й группе — у 5 (7,8%) (р>0,05). Впервые возникший венозный тромбоз в 1-й группе наблюдался у 60 (88,2%) больных, во 2-й группе — у 64 (82,1%), а в 3-й группе — у 54 (84,4%) (p>0,05). Рецидивирующий характер заболевания в 1-й группе установлен у 8 (11,8%) больных, во 2-й группе — у 14 (17,9%), а в 3-й группе — у 7 (15,6%) больных (p>0,05). По данным УЗАС у всех больных с проксимальным ТГВ при госпитализации установлено окклюзионное поражение глубоких вен нижних конечностей. Наблюдалось преобладание проксимальных тромбозов (поражение бедренной вены в сочетании с поражением подколенной и берцовых вен): в 1-й группе — у 33 (48,6%), во 2-й — у 37 (47,4%), в 3-й — у 28 (43,7%) пациентов (p>0,05). На 2-м месте по частоте встречаемости наблюдались тромбозы подвздошного сегмента в сочетании с поражением бедренной, подколенной и берцовых вен. Распределение больных по характеру поражения венозного русла представлено в таблице 1. Таким образом, анализируемые группы больных были сопоставимы по полу, возрасту, клиническим проявлениям и течению заболевания, характеру поражения венозного русла. У больных с проксимальным ТГВ в остром периоде были изучены стандартные клинико-лабораторные показатели крови (общий анализ с лейкоцитарной формулой, биохимический анализ, АПТВ, фибриноген, протромбиновый индекс, растворимые фибрин-мономерные комплексы, общий анализ мочи). В остром периоде больные с проксимальным ТГВ получали стандартную терапию согласно Российским клиническим рекомендациям по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО) (2009, 2015), включающую нефракционированный гепарин (НФГ) [15]. В 1-й группе переход на АВК (варфарин) в стартовой дозе 5 мг начинался на 3–5-е сут от начала гепаринотерапии. На 3-е сут с момента назначения варфарина определялось международное нормализованное отношение (МНО). В дальнейшем осуществлялся контроль МНО с коррекцией дозы варфарина до оптимальных значений 2,0–3,0. Амбулаторно контроль за уровнем МНО осуществлялся в течение 1 года в поликлинике по месту жительства с коррекцией дозы варфарина до оптимальных значений 2,0–3,0. Во 2-й группе стартовая терапия НФГ проводилась в течение 5 сут. На 6-е сут гепарин отменялся, назначался дабигатрана этексилат по 150 мг 2 р./сут в течение года [16]. В 3-й группе перевод больных на сулодексид осуществлялся амбулаторно через 2,5–3,0 мес. от начала лечения проксимального ТГВ нижних конечностей [17]. Показаниями для назначения сулодексида являлись невозможность приема и передозировка АВК, отсутствие реканализации на фоне приема АВК и сохраняющийся отечно-болевой синдром, нарушение в системе протеина С, снижение уровня антитромбина III и развитие тромбоцитопении, угнетение фибринолиза. Сулодексид назначался по 600 ЛПЕ в/м в течение 10–15 дней, затем препарат пролонгированно принимался перорально по 250 ЛПЕ 2 р./сут в течение года. Кроме АТТ амбулаторное лечение включало применение компрессионного трикотажа II класса, флеботоников (микронизированная очищенная фракция флавоноидов, диосмин, кверцетин), также рекомендовался активный образ жизни. УЗАС венозной системы нижних конечностей выполнялось при госпитализации больного и накануне выписки на 10–14-е сут на фоне АТТ по стандартным общепринятым методикам [18]. В дальнейшем амбулаторно у пациентов в течение года через 1, 3, 6 и 12 мес. от начала рандомизации изучалась реканализация вен на сканерах Envisor C и Acuson Antares (Германия). По УЗАС определяли протяженность тромбоза, локализацию проксимальной и дистальной границы тромботических масс, наличие бессимптомно протекающего тромбоза в других венозных бассейнах, оценивали признаки появления реканализации и ее степень на различных уровнях системы глубоких вен нижних конечностей. В оценке степени реканализации глубоких вен применялась 4-ступенчатая градация: окклюзия — отсутствие кровотока в вене, слабая — при компрессии ультразвуковым датчиком просвет вены сжимается не более чем на 30%, средняя — просвет вены сжимается не более чем на 50%, хорошая — вена компрессируется более чем на 70% [19]. В 1-й группе УЗАС через 1 мес. проведено у 68 больных, через 3 мес. — у 60, через 6 мес. — у 63, а через 12 мес. — у 62. Во 2-й группе через 1 мес. УЗАС выполнено у 78 больных, через 3 мес. — у 70, через 6 мес. — у 73, а через 12 мес. — у 77. В 3-й группе УЗАС через 1 мес. от начала лечения выполнено у 64 больных, через 3 мес. — у 53, через 6 мес. — у 56, а через 12 мес. — у 61.
Статистическая обработка полученных данных осуществлялась с использованием лицензионных программ Microsoft Office 365 и Statistica, version 10 фирмы StatSoft Inc.
(США), включавших оценку достоверности различия данных 3 анализируемых групп для параметрических вариационных рядов — критерий t Стьюдента, для дитохомных (качественных) данных — критерий z Фишера, а также расчет коэффициента корреляции Пирсона (r).
Для оценки нормальности распределения применялась визуальная оценка частотного распределения (по гистограмме и графику нормальности) с последующим использованием критерия Шапиро — Уилка. Статистически значимыми различия принимались при p
Реканализация глубоких вен нижних конечностей как показатель эффективности лечения острого венозного тромбоза
- Номер 1
- Номер 2
- Номер 3
- Номер 4
Кузнецов М.Р.1, Сапелкин С.В.2, Болдин Б.В.3, Леонтьев С.Г.1, Несходимов Л.А.3
1) Кафедра факультетской хирургии, урологии, Российский национальный исследовательский медицинский университет им. Н.И. Пирогова, 2) Институт хирургии им. А.В. Вишневского Минздрава РФ,
3) Кафедра факультетской хирургии №2, Российский национальный исследовательский медицинский университет им. Н.И. Пирогова, Москва, Россия
Проанализированы результаты обследования и лечения 102 больных с илиофеморальным венозным тромбозом.
В процессе лечения при проведении ультразвукового дуплексного сканирования определяли локализацию проксимальной границы тромботических масс, время появления первых признаков реканализации, ее степень на различных уровнях глубокой венозной системы, изменение скорости венозного кровотока в глубоких венах нижних конечностей. Динамику клинических симптомов оценивали по визуально-аналоговой шкале. Клиническое и инструментальное обследование выполнялось через 10 суток, 1, 3, 6 и 12 месяцев от начала лечения. Больные были разделены на 3 группы. В 1 группу вошли 38 больных, которым проводилась терапия низкомолекулярным гепарином (эноксапарин) с последующим переходом на непрямые антикоагулянты (варфарин) в сочетании с венотониками (оригинальный высокоочищенный диосмин 600 мг 1 раз в сутки). Во 2 группу были включены 33 пациента, получавшие Ривароксабан (Ксарелто) по 15 мг два раза в сутки в течение 3 недель, далее по 20 мг один раз в сутки. Больные 3 группы (31 пациент) также получали Ривароксабан (Ксарелто) по описанной выше стандартной схеме, но в комбинации с венотониками (оригинальный высокоочищенный диосмин 600 мг 1 раз в сутки).
Исследование показало, что назначение больным с первого дня заболевания Ривароксабана (Ксарелто) позволило значительно улучшить и ускорить процессы восстановления проходимости глубоких вен нижних конечностей по сравнению с пациентами, получавшими антагонисты витамина К (варфарин).
У больных, принимающих ривароксабан (ксарелто), не выявлено ни одного случая остаточных тромботических окклюзий магистральных вен, а реканализация у трех четвертей пациентов была расценена как хорошая и еще одной четверти – как средней степени.
В группе варфарина у 13% больных сохранялась окклюзия в подвздошных венах, а хорошая реканализация наблюдалась только у половины больных.
Добавление к антикоагулянтам с первого дня лечения венотоников (оригинального высокоочищенного диосмина) продемонстрировало безопасность этой схемы лечения (ни у одного больного не было выявлено клинически значимых геморрагических осложнений) и ее большую эффективность по сравнению с монотерапией Ривароксабаном (Ксарелто). Комбинация диосмина с Ривароксабаном (Ксарелто) была эффективней, чем сочетание Диосмина и Варфарина.
КЛЮЧЕВЫЕ СЛОВА: острый венозный тромбоз, посттромботическая болезнь, хроническая венозная недостаточность, антикоагулянты, венотоники, ривароксабан (ксарелто), варфарин, диосмин.
Стр. 82-87
Посттромбофлебитическая болезнь (ПТФБ) – одна из наиболее тяжелых форм хронической венозной недостаточности (ХВН), достаточно часто приводящая к развитию трофических расстройств, вплоть до плохо поддающихся лечению трофических язв [1]. Наиболее тяжело протекает ПТФБ после перенесенного илиофеморального флеботромбоза (ИФФТ) [2].
Связано это с недостаточной реканализацией и остаточными окклюзиями на всем протяжении пораженных глубоких вен нижних конечностей, особенно на проксимальном уровне (подвздошные, бедренная вены) [3].
Как правило, процессы реканализации наиболее активно происходят в течение первых 6-12 месяцев после перенесенного острого венозного тромбоза, после чего динамика морфологических изменений в глубоких венах уже не становится столь значимой [4].
Как правило, при сформированной ПТФБ наиболее часто проводят консервативную терапию, несмотря на наличие остаточных участков окклюзий магистральных вен, поскольку хирургические реконструктивные операции имеют плохие результаты как в ближайшем, так и в отдаленном послеоперационном периоде, и могут усугубить явления ХВН [5].
Эндоваскулярные методы лечения пока имеют ограниченное применение в связи с техническими сложностями и отсутствием должного количества наблюдений в отдаленном периоде [6]. В связи с этим возникает потребность адекватного лечения острого венозного тромбоза, позволяющего добиться более полной и быстрой реканализации глубоких вен нижних конечностей [7-9]. При этом высказываются мнения о возможности сочетанного применения антикоагулянтов и венотоников [10].
Цель исследования: оценить эффективность методов консервативного лечения острого венозного тромбоза глубоких вен нижних конечностей c позиций предотвращения или более легкого течения ПТФБ.
Материалы и методы
Проанализированы результаты обследования и лечения 102 больных с ИФФТ. У всех пациентов проксимальный уровень тромба находился выше паховой связки (наружная или общая подвздошные вены). Больные, которым проводилась хирургическая профилактика тромбоэмболии легочной артерии, в настоящее исследование не включались.
В процессе лечения при проведении ультразвукового дуплексного сканирования определяли локализацию проксимальной границы тромботических масс, время появления первых признаков реканализации, ее степень на различных уровнях глубокой венозной системы, изменение скорости венозного кровотока в глубоких венах нижних конечностей.
Степень реканализации оценивали по методике, разработанной в нашей клинке и внедренной в практическое здравоохранение [11]: 1 – слабая (при компрессии ультразвуковым датчиком сжимается лишь небольшая часть просвета вены, не более 30%); 2 – средняя (при компрессии сжимается около 50% просвета вены); 3 – хорошая (сжимается более 70% просвета вены). Степень выраженности клинических симптомов (тяжесть в ногах, отеки, парестезии) оценивали в динамике по визуально-аналоговой шкале. Наблюдение за всеми больными проводилось в течение одного года. Клиническое и инструментальное обследование выполнялось через 10 суток, 1, 3, 6 и 12 месяцев от начала лечения.
Больные были разделены на 3 группы, сопоставимые по полу, возрасту, сопутствующей патологии и локализации поражения.
В 1 группу вошли 38 больных, которым проводилась терапия низкомолекулярным гепарином (эноксапарин) с последующим переходом на непрямые антикоагулянты (варфарин) в сочетании с венотониками (оригинальный высокоочищенный диосмин 600 мг 1 раз в сутки).
Во 2 группу были включены 33 пациента, получавшие ривароксабан по 15 мг два раза в сутки в течение 3 недель, далее по 20 мг один раз в сутки.
Больные 3 группы (31 пациент) также получали ривароксабан по описанной выше стандартной схеме, но в комбинации с венотониками (оригинальный высокоочищенный диосмин 600 мг 1 раз в сутки). Венотоники, как и антикоагулянты, больные получали с первого дня лечения на протяжении 12 месяцев. Кроме этого, все пациенты носили на протяжении всего срока наблюдения эластический компрессионный трикотаж 2 класса компрессии.
Статистический анализ результатов проводился с использованием непараметрических методов: при сравнении независимых групп применялся U-критерий Манна-Уитни, при сравнении связанных групп (анализ динамики в процессе лечения) – критерий Вилкоксона.
Результаты
Ни у одного больного во всех трех группах на протяжении всего срока наблюдения (12 месяцев) не было случаев клинически значимых геморрагических осложнений. В то же время у всех пациентов первые признаки реканализации были отмечены на 10 сутки в венах голени, а у ряда больных – и в подколенной вене; при этом статистически значимых различий между группами выявлено не было.
В дальнейшем через 1 месяц после начала лечения определялась реканализация и более проксимальных сегментов вен, степень которой в группах различалась.
В данной статье мы приводим динамику степени реканализации подвздошного сегмента, поскольку восстановление проходимости в нем происходит в самую последнюю очередь и, в целом, определяет венозную гемодинамику после перенесенного острого тромбоза [4].
Как видно из представленных в табл. 1 данных, через 1 месяц после начала лечения ни у одного больного еще не было признаков хорошей реканализации подвздошных вен, при этом полное ее отсутствие определялось в 1 группе у 31,6% больных, во 2 группе – у 27,3%, в 3 группе – у 19,4%.
Доля больных со слабой и средней степенью реканализации на этом этапе исследования в разных группах статистически значимо не различалась. Различие начинало определяться спустя 3 месяца лечения.
Так, у больных 1 группы в 13,2% случаев сохранялась окклюзия проксимального сегмента, в то время как у всех пациентов 2 и 3 групп определялись в той или иной степени признаки восстановления проходимости подвздошных вен. Еще большее различие отмечалось на более поздних этапах наблюдения – через 6 и 12 месяцев лечения.
Так, у больных 1 группы сохранялась окклюзия подвздошного сегмента в 13,2% случаев и через 6, и через 12 месяцев наблюдения. Хорошая же реканализация через 6 месяцев наступила у 44,7% пациентов 1 группы, у 63,6% больных 2 группы и у 80,7% пациентов 3 группы.
Через 12 месяцев хорошая реканализация наблюдалась у 50% больных 1 группы, 75,8% больных 2 группы и подавляющего большинства (93,6% пациентов) 3 группы.
Важно отметить, что у пациентов 2 и 3 групп через 6 и 12 месяцев наблюдения не было выявлено не только случаев окклюзии подвздошного сегмента, но и слабой реканализации: в единичных случаях наблюдалась средняя степень реканализации и в большинстве – хорошая.
Обращало также на себя внимание то, что сформировавшаяся к трем месяцам наблюдения окклюзия вены у больных 1 группы в дальнейшем не претерпевала каких-либо изменений, в то время как начавшаяся реканализация постепенно прогрессировала.
Было отмечено, что более ранние признаки реканализации способствовали более полному и быстрому процессу восстановления проходимости магистрального венозного русла, что наблюдалось преимущественно у пациентов 2 и 3 групп, в то время как у больных 3 группы к концу периода наблюдения в подавляющем большинстве случаев были выявлены наиболее выраженные положительные результаты лечения. В связи с этим становится очевидным, что для более полного восстановления проходимости магистральных вен нижних конечностей после перенесенного ИФФТ требуется более раннее назначение адекватной антикоагулянтной терапии, одним из вариантов которой может быть ривароксабан. Добавление же к терапии с первых суток лечения оригинального высокоочищенного диосмина способствует более быстрому и полному наступлению клинического эффекта.
Таблица 1. Степень реканализации подвздошных венпри лечении острого илиофеморального тромбоза.
| 1 месяц | Окклюзия | 12 (31,6%) | 9 (27,3%) | 6 (19,4%) |
| Слабая | 21 (55,3%) | 18 (54,5%) | 20 (64,5%) | |
| Средняя | 5 (13,1%) | 6 (18,2%) | 5 (16,1%) | |
| Хорошая | ||||
| 3 месяца | Окклюзия | 5 (13,1%) | ||
| Слабая | 18 (47,4%) | 11 (33,3%) | 7 (22,6%) | |
| Средняя | 7 (18,4%) | 13 (39,4%) | 14 (45,2%) | |
| Хорошая | 8 (21%) | 9 (27,3%) | 10 (32,2%) | |
| 6 месяцев | Окклюзия | 5 (13,2%) | ||
| Слабая | 6 (15,8%) | |||
| Средняя | 10 (26,3%) | 12 (36,4%) | 6 (19,4%) | |
| Хорошая | 17 (44,7%) | 21 (63,6%) | 25 (80,6%) | |
| 12 месяцев | Окклюзия | 5 (13,2%) | ||
| Слабая | 6 (15,8%) | |||
| Средняя | 8 (21%) | 8 (24,2%) | 2 (6,5%) | |
| Хорошая | 19 (50%) | 25 (75,8%) | 29 (93,5%) |
При анализе динамики скорости кровотока в подколенной вене, несмотря на то, что первые признаки ее реканализации были выявлены у многих пациентов уже на 10 сутки лечения во всех группах, корректное определение скоростных показателей на этом этапе было невозможно.
Поэтому мы проводили сравнение скорости тока крови в процессе лечения с показателем, регистрируемым через 1 месяц наблюдения, когда у всех больных отмечалась достаточная реканализация подколенной вены и можно было с большой долей достоверности определить скорость кровотока.
Подколенная вена была выбрана потому, что, с одной стороны, в ней быстрее, чем в более проксимальных сегментах восстанавливается кровоток, а с другой – в отличие от вен голени кровоток в подколенной вене имеет более постоянную и достоверную величину.
Как видно из данных, представленных в табл. 2, имелись статистически значимые различия между группами на всех этапах наблюдения. Так, через 3 месяца скорость кровотока в подколенной вене в 1 группе увеличилась на 17,2±3,1%. При этом скорость кровотока у больных 2 группы была больше в 1,5 раза (p
Реканализация тромбов: что это, как происходит — естественная, медикаментозная, хирургическая
При возникновении тромбоза из-за закупорки сосуда происходит нарушение кровообращения. Это приводит к постепенной атрофии органа и сопутствующим осложнениям.
Чтобы восстановить функцию пораженного органа и предотвратить развитие нежелательных процессов проводятся меры по расширению просвета сосуда. К ним относится реканализация тромба.
В здоровом организме она осуществляться физиологическим путем под воздействием плазмина. Если этого не происходит, то тромб удаляют хирургическим вмешательством или с помощью медикаментов.
Разновидности реканализации и их особенности
В зависимости от условий, в которых происходит восстановление просвета сосуда после тромбоза, выделяют:
- Естественную реканализацию;
- Медикаментозную;
- Хирургическую.
Естественное растворение тромбов возможно только при относительно маленьких их размерах, в противном случае организм пытается хоть как-то восстановить кровоток, превращая крупный тромб в подобие сита, пронизанного сосудистыми каналами, пропускающими кровь.
Фибринолитическая система активируется вместе с системой свертывания, что предотвращает избыточное тромбообразование и способствует разрушению микротромбов. Фибрин растворяется плазмином, активизируемым седьмым фактором свертывания крови.
Лизис тромба системой фибринолиза можно считать идеальным развитием событий, так как после этого происходит полная реканализация сосуда, а тромботические массы растворяются ферментами, однако при внутриартериальных, венозных и сердечных тромбах больших размеров он малоэффективен, и восстановление кровотока возможно разве что за счет частичной реканализации.
Преобразование крупного тромба начинается с его организации, то есть прорастания соединительнотканными волокнами. Этот процесс начинается с головки тромба — места, где он крепится к сосудистой стенке и куда со стороны внутренней выстилки артерии или вены проникает соединительная ткань. Начальные признаки реканализации можно заметить уже в конце первых 1-2 недель с момента тромбирования.
По мере того, как тромботические массы замещаются фиброзной тканью, в них возникают узкие щели и каналы, в которые внедряется эндотелий — происходит реканализация сосудов.
Каналы внутри тромба становятся подобием сосудов с соответствующей выстилкой, стенка приобретает черты артериальной или венозной (в зависимости от локализации тромбоза), сквозь полости начинает циркулировать кровь, и тогда говорят о васкуляризации тромба. Описанные изменения происходят на протяжении нескольких недель.
Видео: пример естественной реканализации тромба в синусе икроножной мышцы
Причины образования тромбов
Способность крови к свертыванию – выработавшееся в процессе эволюции важнейшее качество, предотвращающее кровопотери в случае небольших травм. Сгущаясь, кровь образует своеобразные пробки, перекрывающие поврежденные сосуды и таким образом останавливающие кровотечение.
Если человек здоров и его сосудистая система в порядке, то по мере того, как в них отпадает надобность, они «самоликвидируются» – рассасываются под воздействием механизма фибринолиза.
Но при возникновении различных патологий процессы тромбирования активизируются, а самоликвидация затрудняется, и защитный фактор приобретает прямо противоположное значение.
Читать также: Можно ли приседать при варикозе нижних конечностей
Причин может быть несколько:
- изменение структуры сосудистой стенки (истончение, хрупкость);
- чрезмерная густота крови;
- нарушение нормальной скорости кровотока.
Когда образование сгустка происходит вследствие атеросклеротических явлений, слипающиеся эритроциты, из которых состоит его «тело», оседают на поверхности холестериновых бляшек, появляющихся в кровяном русле. Иногда стенки артерий настолько истончаются, что биологическая субстанция начинает просачиваться сквозь них, и организм, стремясь устранить кровотечение, усиливает тромбирование.
Застойным явлениям кровотока способствует малоподвижный образ жизни, работа, требующая длительных статичных поз (сидячих и стоячих), а также вредные привычки: курение, неправильное питание, злоупотребление кофе.
Кроме того, причиной тромбирования могут стать:
- Токсикологическое и химическое отравление.
- Хирургическая операция – возникающие при этом кровопотери организм стремится устранить, увеличивая образование «заплаток».
- Варикозное расширение вен.
Во всех этих случаях необходимо постоянное наблюдение специалиста и диагностирование состояния сосудистой системы. Последствия возможных осложнений ситуации в виде тромбоэмболии при отсутствии своевременной диагностики и медицинской помощи крайне трагичны, вплоть до летального исхода.
Медикаментозная реканализация
Консервативным путем проводить реканализацию сосудов допустимо в тех случаях, когда тромбоз не угрожает жизни пациента. Такая терапия проводится в первые трое суток с момента тромбоза, и чем раньше она будет начата, тем выше вероятность благоприятного исхода. Оптимально начинать вводить препараты в первые 6 часов.
Для восстановления кровотока применяют:
- Антикоагулянты;
- Антиагреганты;
- Тромболитики;
- Ангиопротекторы.
Тромболитическая терапия проводится препаратами, растворяющими тромботические массы в просвете сосуда. Фибринолитическое лечение назначается только в условиях стационара и под контролем врача, поскольку имеет противопоказания, игнорирование которых может привести к тяжелым осложнениям.
Транскатетерное протезирование аортального клапана (TAVI)
Фибринолитические средства призваны растворить кровяной сверток в просвете артерии или вены. Они применяются для реканализации артерии при острых расстройствах кровообращения в сердце (инфаркт, острый коронарный синдром), острой артериальной непроходимости в конечностях и др.
В настоящее время используются фибринолитики трех поколений:
- Первое поколение — стрептокиназа, урокиназа — довольно эффективны, но дают частые аллергические реакции, повышают риск кровотечения в процессе тромболизиса;
- Второе поколение — альтеплаза, актилаза — действуют избирательно на тромботические массы, кроверазжижающий эффект меньше выражен нежели у препаратов первого поколения, поэтому и риск кровотечений ниже;
- Третье — тенектеплаза, ретаплаза.
В целях растворения свертка при артериальном тромбозе используется фибринолизин, вводимый в вену капельно вместе с гепарином на протяжении 2-3 суток.
После окончания лечения фибринолизином необходимо продолжить применение антикоагулянтных средств.
Недостатком препарата считается его быстрая инактивация антиплазмином крови пациента, что не характерно для более эффективных средств — стрептаза и урокиназа.
Фибринолитическая терапия проводится в стационаре, пациенту назначается постельный режим, а внутривенное введение лекарств может продолжаться часами, итогом чего станет полная или частичная реканализация тромба.
Традиционно для лечения тромбоза применяются антикоагулянты прямого и непрямого действия. Они ограничивают увеличение тромба, стабилизируя его размеры.
Непрямые антикоагулянты уменьшают выработку витамина К печенью, из-за чего замедляется продукция тромбина, и рост тромба прекращается. К этой группе лекарств относят дикумарин, синкумар, варфарин, фенилин и другие.
Их назначают с третьих суток от момента закупорки сосуда.
Прямые антикоагулянты — гепарин, фраксипарин, клексан — воздействуют на факторы свертывания крови и прекращают местное тромбообразование, однако при их применении есть вероятность аллергических реакций и повышения кровоточивости, что особенно выражено при введении гепарина.
Острые артериальные тромбозы требуют незамедлительной и комплексной терапии, включающей введение анальгетиков, спазмолитиков (дротаверин, галидор) и антикоагулянтов прямого действия в первые 1-2 дня (гепарин внутривенно, а затем — внутримышечно).
Непрямые антикоагулянты начинают действовать спустя примерно сутки, поэтому начинать лечение тромбоза с них нельзя, но целесообразным считается комбинировать их с гепарином и его производными. Курс лечения продолжается 2-3 недели, то есть до момента организации и реканализации просвета сосуда.
Антиагреганты препятствуют склеиванию тромбоцитов в просвете сосудов и на их стенках, предотвращая рост тромба. Наиболее доступный антиагрегант — аспирин, который широко применяется в кардиологической практике для лечения и профилактики тромбозов коронарных сосудов.
Сосудистые протекторы и венотоники применяют при венозном застое с тромбозом, так как они способны повышать тонус вен и уменьшать проницаемость капилляров. Улучшение микроциркуляции и реологических характеристик крови способствует снижению риска тромбообразования и восстановлению сосудистой проходимости. Используются пентоксифиллин, трентал, пармидин.
Антикоагулянты уменьшают свертываемость, однако практически не влияют на фибринолиз, поэтому цель их назначения — профилактика повторных тромбозов и роста уже имеющегося свертка. Для реканализации вен после тромбоза или артерий все же необходима фибринолитическая терапия.
При хронических окклюзиях артерий и вен применяют сулодексид, оказывающий ангиопротективное и профибринолитическое действие. Препарат улучшает реканализацию при тромбозе глубоких вен голеней, снижая выраженность посттромбофлебитического синдрома.
Сулодексид улучшает реологические показатели крови, нормализует структуру эндотелиальной выстилки сосудов, способствует прекращению роста тромба и его стабилизации, улучшает микроциркуляцию и обладает венотонизирующими свойствами. Принимать его можно перорально, при этом не требуется постоянного контроля гемостазиограммы.
Важным преимуществом сулодексида можно считать не только остановку тромбообразования и реканализацию пораженных сосудов, но и возможность его применения для профилактики повторных тромбозов и лечения хронической венозной недостаточности.
Добиться более полной реканализации вен ног после тромбоза помогает препарат Ксарелто (ривароксабан). Он эффективнее непрямых антикоагулянтов, может применяться одновременно с венотониками и является довольно безопасным в плане развития геморрагических осложнений.
Естественное восстановление кровотока в сосудах
Возникновение тромбов считается естественным явлением, развивающимся в результате каких-либо повреждений стенки кровеносного сосуда.
Образовавшийся вследствие этого сгусток крови играет роль пробки, которая закупоривает участок поврежденной вены и восстанавливает его соединительную ткань, тем самым не давая организму человека потерять много крови, что может представлять опасность для жизни.
После завершения главной функции тромб под воздействием системы фибринолиза — естественного процесса растворения кровяных новообразований в венах — лизируется, то есть рассасывается, вследствие чего нормальная проходимость сосуда опять восстанавливается.
Однако такое новообразование может представлять достаточно серьезную угрозу для жизни человека, так как при отрыве оно будет двигаться по кровотоку и может окончательно закупорить и повредить полость какой-либо из вен или артерий. В некоторых случаях патологический сгусток может обрастать соединительной тканью, в которой со временем образуются небольшие полости, в дальнейшем трансформирующиеся в сосуды.
Хирургическая реканализация
В случае тяжелых тромбозов, закупорки артерий жизненно важных органов, когда либо нет времени на ожидание естественной реканализации и проведение консервативного лечения, либо сам тромб несет угрозу жизни, врачи проводят хирургическую реканализацию, восстанавливая проходимость сосуда при операции. Оперативное лечение может проводиться в случае отсутствия результата от медикаментов, а перед операцией гепарины и другие антикоагулянты отменяются.
пример стентирования артерии при атеросклерозе или атеротромбозе
В целях реканализации артерии или вены производят:
- Хирургическое удаление тромба из просвета сосуда при эндоваскулярных вмешательствах, когда внутрисосудисто вводится катетер, захватывающий и выводящий сверток крови наружу;
- Шунтирующие операции при невозможности извлечения тромба в месте его образования, когда накладывается обходной путь кровотока с использованием собственных тканей (вены) или синтетических материалов;
- Перевязку сосуда выше и ниже зоны обструкции, после чего «включаются» коллатерали и налаживается кровообращение в обход пораженной вены или артерии;
- Установку стентов — специальная трубка или пружина, расширяющая просвет сосуда в месте тромбирования (при поражении коронарных, мозговых, шейных артерий).
Помимо описанных способов реканализации, важно личное участие пациента в лечении патологии и предупреждении повторных эпизодов тромбообразования. Нужно не только следовать назначениям врачей, но и изменить образ жизни, характер питания, избавиться от вредных привычек.
В случае хронических тромботических поражений вен ног, что нередко сопутствует варикозу, могут применяться сразу несколько подходов: медикаментозное лечение, компрессионный трикотаж и двигательная активность, хирургическая коррекция по показаниям.
Диагностика сосудов
Необходимость проведения медицинской реканализации определяется с помощью инструментальных методов исследования. Состояние сосудов и степень нарушения кровотока оцениваются следующими методами:
- дуплексного сканирования – определения скорости кровотока по исследуемому сосуду и анатомические дефекты вен и артерий;
- ангиографии — рентгенологического метода, с помощью которого путем введения контраста обнаруживаются препятствия на пути кровотока: тромбы, сужения;
- компьютерной и магнитно-резонансной томографии — высокоточных методов диагностики, позволяющих обнаружить патологические процессы во всех органах и тканях, в том числе в кровеносных сосудах.
закрытие
Закрытие пупочной вены обычно происходит после того , как пупочная артерия была закрыта. Это удлиняет связь между плацентой и сердца плода, что позволяет рода аутотрансфузии оставшейся крови из плаценты к плоду.
В течение недели после рождения, пупочной вены новорожденного полностью стирается и заменяется фиброзной корда называется круглой связки печени (также называемый Ligamentum Терес hepatis ). Он простирается от пупка к поперечной щели, где он соединяется с серповидной связкой печени в отдельный сегмент 4 из сегментов 2 и 3 левой доли печени .
Дополнительные изображения
- Модель человеческого эмбриона 1,3 мм. долго.
- Схема плацентарного кровообращения.
- Схема сосудистых каналов в человеческом зародыше второй недели.
- Человеческий эмбрион с сердцем и передней стенкой тела удалено, чтобы показать пазухи венозные и ее притоки.
- Схематическое фигура из сальниковой сумки и т.д. человеческого эмбриона восемь недель.
- Печень с перегородкой transversum. Человеческий эмбрион 3 мм. долго.
- Хвост конец человеческого эмбриона двадцать пять двадцать девять дней.
- пупочная вена
- Человеческий эмбрион, 38 мм, 8-9 недель.

 У больных с проксимальным ТГВ в остром периоде были изучены стандартные клинико-лабораторные показатели крови (общий анализ с лейкоцитарной формулой, биохимический анализ, АПТВ, фибриноген, протромбиновый индекс, растворимые фибрин-мономерные комплексы, общий анализ мочи). В остром периоде больные с проксимальным ТГВ получали стандартную терапию согласно Российским клиническим рекомендациям по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО) (2009, 2015), включающую нефракционированный гепарин (НФГ) [15]. В 1-й группе переход на АВК (варфарин) в стартовой дозе 5 мг начинался на 3–5-е сут от начала гепаринотерапии. На 3-е сут с момента назначения варфарина определялось международное нормализованное отношение (МНО). В дальнейшем осуществлялся контроль МНО с коррекцией дозы варфарина до оптимальных значений 2,0–3,0. Амбулаторно контроль за уровнем МНО осуществлялся в течение 1 года в поликлинике по месту жительства с коррекцией дозы варфарина до оптимальных значений 2,0–3,0. Во 2-й группе стартовая терапия НФГ проводилась в течение 5 сут. На 6-е сут гепарин отменялся, назначался дабигатрана этексилат по 150 мг 2 р./сут в течение года [16]. В 3-й группе перевод больных на сулодексид осуществлялся амбулаторно через 2,5–3,0 мес. от начала лечения проксимального ТГВ нижних конечностей [17]. Показаниями для назначения сулодексида являлись невозможность приема и передозировка АВК, отсутствие реканализации на фоне приема АВК и сохраняющийся отечно-болевой синдром, нарушение в системе протеина С, снижение уровня антитромбина III и развитие тромбоцитопении, угнетение фибринолиза. Сулодексид назначался по 600 ЛПЕ в/м в течение 10–15 дней, затем препарат пролонгированно принимался перорально по 250 ЛПЕ 2 р./сут в течение года. Кроме АТТ амбулаторное лечение включало применение компрессионного трикотажа II класса, флеботоников (микронизированная очищенная фракция флавоноидов, диосмин, кверцетин), также рекомендовался активный образ жизни. УЗАС венозной системы нижних конечностей выполнялось при госпитализации больного и накануне выписки на 10–14-е сут на фоне АТТ по стандартным общепринятым методикам [18]. В дальнейшем амбулаторно у пациентов в течение года через 1, 3, 6 и 12 мес. от начала рандомизации изучалась реканализация вен на сканерах Envisor C и Acuson Antares (Германия). По УЗАС определяли протяженность тромбоза, локализацию проксимальной и дистальной границы тромботических масс, наличие бессимптомно протекающего тромбоза в других венозных бассейнах, оценивали признаки появления реканализации и ее степень на различных уровнях системы глубоких вен нижних конечностей. В оценке степени реканализации глубоких вен применялась 4-ступенчатая градация: окклюзия — отсутствие кровотока в вене, слабая — при компрессии ультразвуковым датчиком просвет вены сжимается не более чем на 30%, средняя — просвет вены сжимается не более чем на 50%, хорошая — вена компрессируется более чем на 70% [19]. В 1-й группе УЗАС через 1 мес. проведено у 68 больных, через 3 мес. — у 60, через 6 мес. — у 63, а через 12 мес. — у 62. Во 2-й группе через 1 мес. УЗАС выполнено у 78 больных, через 3 мес. — у 70, через 6 мес. — у 73, а через 12 мес. — у 77. В 3-й группе УЗАС через 1 мес. от начала лечения выполнено у 64 больных, через 3 мес. — у 53, через 6 мес. — у 56, а через 12 мес. — у 61.
У больных с проксимальным ТГВ в остром периоде были изучены стандартные клинико-лабораторные показатели крови (общий анализ с лейкоцитарной формулой, биохимический анализ, АПТВ, фибриноген, протромбиновый индекс, растворимые фибрин-мономерные комплексы, общий анализ мочи). В остром периоде больные с проксимальным ТГВ получали стандартную терапию согласно Российским клиническим рекомендациям по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО) (2009, 2015), включающую нефракционированный гепарин (НФГ) [15]. В 1-й группе переход на АВК (варфарин) в стартовой дозе 5 мг начинался на 3–5-е сут от начала гепаринотерапии. На 3-е сут с момента назначения варфарина определялось международное нормализованное отношение (МНО). В дальнейшем осуществлялся контроль МНО с коррекцией дозы варфарина до оптимальных значений 2,0–3,0. Амбулаторно контроль за уровнем МНО осуществлялся в течение 1 года в поликлинике по месту жительства с коррекцией дозы варфарина до оптимальных значений 2,0–3,0. Во 2-й группе стартовая терапия НФГ проводилась в течение 5 сут. На 6-е сут гепарин отменялся, назначался дабигатрана этексилат по 150 мг 2 р./сут в течение года [16]. В 3-й группе перевод больных на сулодексид осуществлялся амбулаторно через 2,5–3,0 мес. от начала лечения проксимального ТГВ нижних конечностей [17]. Показаниями для назначения сулодексида являлись невозможность приема и передозировка АВК, отсутствие реканализации на фоне приема АВК и сохраняющийся отечно-болевой синдром, нарушение в системе протеина С, снижение уровня антитромбина III и развитие тромбоцитопении, угнетение фибринолиза. Сулодексид назначался по 600 ЛПЕ в/м в течение 10–15 дней, затем препарат пролонгированно принимался перорально по 250 ЛПЕ 2 р./сут в течение года. Кроме АТТ амбулаторное лечение включало применение компрессионного трикотажа II класса, флеботоников (микронизированная очищенная фракция флавоноидов, диосмин, кверцетин), также рекомендовался активный образ жизни. УЗАС венозной системы нижних конечностей выполнялось при госпитализации больного и накануне выписки на 10–14-е сут на фоне АТТ по стандартным общепринятым методикам [18]. В дальнейшем амбулаторно у пациентов в течение года через 1, 3, 6 и 12 мес. от начала рандомизации изучалась реканализация вен на сканерах Envisor C и Acuson Antares (Германия). По УЗАС определяли протяженность тромбоза, локализацию проксимальной и дистальной границы тромботических масс, наличие бессимптомно протекающего тромбоза в других венозных бассейнах, оценивали признаки появления реканализации и ее степень на различных уровнях системы глубоких вен нижних конечностей. В оценке степени реканализации глубоких вен применялась 4-ступенчатая градация: окклюзия — отсутствие кровотока в вене, слабая — при компрессии ультразвуковым датчиком просвет вены сжимается не более чем на 30%, средняя — просвет вены сжимается не более чем на 50%, хорошая — вена компрессируется более чем на 70% [19]. В 1-й группе УЗАС через 1 мес. проведено у 68 больных, через 3 мес. — у 60, через 6 мес. — у 63, а через 12 мес. — у 62. Во 2-й группе через 1 мес. УЗАС выполнено у 78 больных, через 3 мес. — у 70, через 6 мес. — у 73, а через 12 мес. — у 77. В 3-й группе УЗАС через 1 мес. от начала лечения выполнено у 64 больных, через 3 мес. — у 53, через 6 мес. — у 56, а через 12 мес. — у 61.