Главная » Эхокардиография » 2021 » Апрель » 11 » Уплотнение аорты сердца на эхокардиографии
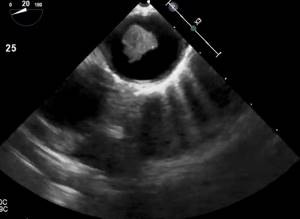
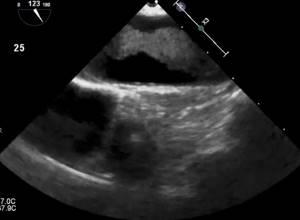
Атерома грудного отдела аорты обычно адекватно не визуализируется с помощью трансторакальной эхокардиографии и чаще всего в заключении пишут об уплотнении аорты. Таким образом, предпочтительным методом визуализации является ЧПЭхоКГ. Обычно аорта делится на три части: восходящая часть, дуга аорты и нисходящая аорта. С точки зрения риска церебральной эмболии наибольший интерес представляют восходящая грудная аорта и дуга аорты, проксимальнее места начала левой общей сонной артерии. При чреспищеводной эхокардиографии корень аорты лучше всего виден в продольной оси аортального клапана (~ 120°). Незначительное выдвижение датчика с уменьшением угла поворота (~ 90–100°) даст удовлетворительную визуализацию по длинной оси восходящей аорты в виде трубчатой структуры. На стыке верхней восходящей аорты и дуги аорты имеется эхокардиографическое слепое пятно из-за взаимного расположения левого главного бронха. Визуализация нисходящей аорты начинается в трансжелудочном разрезе.
Эхокардиографическое обследование при уплотнении аорты Атеросклеротические изменения грудной аорты все чаще признаются потенциально важным источником эмболии. Обычно сообщается о вращении ультразвукового зонда, при котором нисходящая грудная аорта попадает в окно визуализации. Нисходящая аорта находится позади и очень близко к верхней части желудка и пищевода, и глубина плоскости изображения должна быть отрегулирована для увеличения аорты. Ассоциация атеромы грудной аорты и инсульта на эхокардиографииНаблюдательные серии случай-контроль показали значительно более высокую распространенность сложной атеромы (подвижная или изъязвленная бляшка и бляшка толщиной> 4 мм) у пациентов с инсультом (21–27%) по сравнению с контрольной группой (4–13%). В проспективных исследованиях частота инсульта через 1 год у пациентов с выступающей атеромой составила 12%, а частота всех эмболических событий — 33%. Комбинация фибрилляции предсердий и сложной аортальной бляшки связана с более высоким риском инсульта (12–20% в течение 1 года) по сравнению с риском инсульта 1–2% для пациентов с фибрилляцией предсердий без значительного уплотнения аорты и бляшек. Независимо от антикоагуляции или аспирина, это еще одно свидетельство того, что независимый значительный эмболический потенциал связан с атеромой аорты. На распространенность инсульта или других эмболических событий, по-видимому, влияет морфология бляшек. Размер бляшек (толщина), кальцификация атеромы и их подвижность — все это важные характеристики. Увеличение толщины атеромы на эхокардиографии связано с более высоким риском инсульта с порогом 4 мм, в частности, связано со значительно более высоким риском инсульта. Значение видимого изъязвления бляшек неясно с имеющимися данными, предполагающими, что изъязвление в более тонких бляшках связано с повышенным риском, в то время как эта взаимосвязь не значима в более толстых (> 4 мм) бляшках. Наличие кальцификации в бляшках связано со снижением риска эмболических событий, что, вероятно, объясняется тем фактом, что кальцификация, скорее всего, представляет собой наличие более хронических фиброзных бляшек с меньшим содержанием липидов. Мобильные компоненты атеромы аорты также связаны с повышенным риском эмболии с эхопатологической корреляцией, предполагающей, что эти мобильные элементы являются тромбом. Основываясь на текущих данных, похоже, что большинство эмболических событий, связанных с атеросклерозом аорты, являются вторичными по отношению к эмболизации тромбом, который образовался на этих атеросклеротических поражениях. Эмболия во время манипуляции с аортой Существует риск эмболии при манипуляциях на аорте во время кардиохирургических операций или катетеризации левых отделов сердца. Эмболические осложнения при катетеризации сердца редки (частота инсульта 0,5%). Однако, когда все же возникают эмболические осложнения, часто встречается атерома аорты. Сообщаемая частота эмболических осложнений во время кардиохирургических вмешательств с использованием искусственного кровообращения составляет 2–7%. Пациенты с атеромой аорты> 5 мм на ЧПЭхоКГ имеют значительно более высокий риск интраоперационного инсульта. Интраоперационная или эпикардиальная эхокардиография используется для оценки аорты, чтобы помочь стратифицировать риск этих пациентов и найти безопасную точку для введения канюли и пережатия. Ведение пациентов с атеромой аорты Не существует единого мнения относительно оптимального ведения пациентов со сложной атеромой аорты. Использование антитромботических агентов и / или антикоагулянтов представляется логичным, учитывая ключевую роль тромба в эмболических событиях. Терапия аспирином обычно назначается всем пациентам со значительным атеросклеротическим заболеванием. Также обычно рассматриваются ингибиторы HMGCo-A-редуктазы (статины) с их документально подтвержденными преимуществами у людей с атеросклерозом. Уменьшение частоты инсульта было зарегистрировано у пациентов с гиперлипидемией, а также у пациентов с более «нормальным» уровнем холестерина. Несмотря на то, что антикоагулянтная терапия не была проспективно оценена для пациентов с атеромой аорты, данные наблюдений предполагают, что она, вероятно, полезна. Общий подход к оценке атеросклероза аорты на эхокардиографииСердечно-сосудистый источник эмболии все чаще выявляется при обследовании пациентов с острой церебральной, периферической или висцеральной ишемией. Большинство отчетов сосредоточено на источниках эмболии у пациентов с инсультом. Как уже отмечалось, уровень доказательств, демонстрирующих убедительные причины и следствия, ограничен, и эти потенциальные источники лучше всего описывать как «ассоциации», а не как убедительные причины. Важно тщательно оценить пациентов на предмет всех потенциальных источников, и не исключено обнаружение у него более одного потенциального источника, тем более что распространенность многих из этих факторов увеличивается с возрастом. Кроме того, как заболевание сонной артерии, так и атерома грудной аорты являются проявлениями одного и того же патологического процесса, и неудивительно, что пациенты со значительным атеросклерозом сонных артерий имеют более высокую распространенность атеросклероза дуги аорты, чем пациенты без заболевания сонных артерий. Следовательно, может потребоваться оценка аорты, особенно если неврологическое событие контралатерально стенозу сонной артерии или если заболевание сонной артерии связано с периферическими или висцеральными эмболами. Влияние эхокардиографии на ведение пациентовКак только наступила острая фаза неврологического события, основная цель — выявить любые потенциально излечимые источники и предотвратить повторяющиеся, потенциально фатальные события. Данные показывают, что частота рецидивов для всех подтипов инсульта составляет 9,4% в год и 10% для криптогенного инсульта. Сообщается, что чреспищеводная эхокардиография полезна для стратификации риска у пациентов после инсульта. Одна серия пациентов, за которыми наблюдали в течение 2 лет и которые были разделены на группы низкого и высокого риска (на основании наличия хотя бы одного вероятного или возможного фактора риска эмболии при ЧПЭхоКГ), показала, что пациенты из группы низкого риска чувствовали себя значительно лучше (выживаемость составила 92% против 63%, p = 0,04). В исследовании STEPS (242 пациента после ЧПЭхоКГ по поводу необъяснимого инсульта)при уплотнении аорты, демонстрировала атерому аорты и дилатацию ЛЖ, выявила подгруппы с высоким риском повторного инсульта при лечении одним аспирином, что указывает на потенциальную роль эхокардиографии в помощи в выборе терапии и ее влиянии на исход после индексного церебрального события. Однако необходимы проспективные исследования, чтобы определить, можно ли преобразовать идентификацию предикторов рецидива инсульта в улучшение результатов лечения пациентов. Кардиоэмболические события, связанные с вмешательством При расширенном использовании вмешательств во время лечении сердечно-сосудистых заболеваний наблюдались побочные эффекты, такие как ятрогенные инсульты и системная эмболизация. Коронарная ангиография, одна из наиболее широко используемых процедур, наряду с чрескожной реваскуляризацией, произвела революцию в лечении ИБС. Однако, когда инсульт усложняет эти процедуры, он сводит на нет получаемые от него преимущества и ускоряет нанесение вреда. Использование определенных методов может помочь снизить этот риск. Исследователи показали, что промывание катетеров в нисходящей аорте с последующим продвижением к корню аорты значительно снизило частоту микроэмболизации по сравнению со стандартным препарированием катетера в восходящей аорте. |
Новая пероральная антикоагулянтная терапия (NOAC)
Недавнее внедрение новых методов лечения пероральными антикоагулянтами (NOAC) предоставило больше возможностей для пациентов с неклапанной фибрилляцией предсердий.
Основные преимущества NOAC заключаются в том, что эти агенты не требуют мониторинга, имеют быстрое начало действия и значительно снижают риск внутричерепного кровотечения по сравнению с пероральным антагонистом витамина K (VKA).
Основные недостатки этих агентов заключаются в том, что их использование противопоказано при тяжелой почечной недостаточности и отсутствии антидота, чтобы обратить их действие, когда это необходимо.
В дополнение к использованию NOAC в качестве хронической замены VKA, недавно исследование XVeRT показало, что пероральный ривароксабан можно безопасно использовать в качестве возможной альтернативы терапии VKA для предотвращения тромбоэмболических событий у пациентов, подвергающихся плановой кардиоверсии.
Предпринята попытка расширить использование NOAC для механических сердечных клапанов.
Испытание дабигатрана по сравнению с варфарином у пациентов с механическими клапанами сердца было преждевременно прекращено после включения 252 пациентов из-за повышенного количества случаев тромбоэмболии и кровотечений среди пациентов в группе дабигатрана. Аналогичным образом, исследование RE-ALIGN было прекращено на раннем этапе из-за более высоких тромботических осложнений у пациентов с механическими сердечными клапанами, получавших дабигатран, по сравнению с пациентами, получавшими варфарин. Таким образом, до сих пор данные не подтверждают использование терапии NOAC у пациентов с механическими сердечными клапанами.
Склероз аорты: причины, симптомы, диагностика и лечение в Москве
Склероз аорты является хронической патологией артериальной системы, для которой характерно уплотнение аорты вследствие нарушения обмена холестерина в организме. Наличие атеросклеротических изменений в стенках сосудов чаще всего выявляется у людей пожилого возраста, преимущественно у представителей мужского пола.
Склероз аорты (или, как заболевание еще называют в просторечии – склероз сердца) считается наиболее частой и опасной локализацией патологического процесса. Как правило, холестериновые бляшки располагаются на отдельных участках аорты, однако в сложных случаях они могут поражать всю внутреннюю поверхность кровеносного сосуда.
Ввиду ослабления притока крови к сердцу развивается коронарная недостаточность, которая может привести к летальному исходу.
Кардиологи Юсуповской больницы назначают комплексное лечение при выявлении у пациента склероза аорты, направленное на компенсацию сердечной деятельности, нормализацию липидного обмена, предупреждение тяжелых осложнений.
Склероз аорты: этиология и патогенез
Развитие патологии может быть спровоцировано следующими факторами:
- неправильным питанием;
- хроническими инфекционными заболеваниями – туберкулезом, сифилисом и т.д.;
- эндокринными заболеваниями – сахарным диабетом, ожирением;
- стрессами и высоким уровнем адреналина в крови;
- гипертонией;
- аутоиммунными заболеваниями;
- табакокурением и злоупотреблением алкоголя;
- подагрой;
- малоподвижным образом жизни — гиподинамией;
- отсутствием физических нагрузок;
- наследственной предрасположенностью.
Облегчение состояния больного достигается устранением провоцирующих факторов либо снижением их воздействия.
Патогенез склероза аорты состоит из двух основных механизмов: сосудисто-тромбоцитарного и дислипидемического. В месте скопления тромбоцитов (на повреждении стенки сосуда) происходит образование микротромбов. Вследствие нарушения липидного обмена развивается гиперхолистеринемия.
На сосудистых стенках отмечается скопление жиров, скрепленных с помощью соединительнотканных волокон, таким образом происходит образование атеросклеротических бляшек, по мере роста которых деформируется и сужается просвет сосудов.
Склероз аорты сердца приводит к нарушению его кровоснабжения и развитию дисфункции.
Склероз аорты сердца: клиническая картина
Симптоматика склероза аорты сердца может отличаться в соответствии с общим состоянием сосудов и местом локализации патологического очага. Для патологии характерно длительное, бессимптомное течение.
Первые признаки склероза аорты могут обнаруживаться в пожилом возрасте, что обусловлено значительными патологическими изменениями, износом стенок сосуда. Тревогу у больных вызывает внезапное появление сильной боли в груди, повышение давления, затруднение дыхания, головокружения.
Самочувствие пациента резко ухудшается, появляется одышка, боль в области груди, живота, развивается диспепсия.
У больного, страдающего склерозом аорты, происходит изменение внешнего вида: он выглядит старше своих лет, рано седеет или лысеет, взгляд становится тусклым, ухудшается тонус кожи (на ней отмечается большое количество складок и мелких ангиом), на нижних конечностях появляются трофические нарушения.
Поражение грудной части аорты сопровождается периодической жгучей болью в груди, осиплостью или охриплостью голоса, дисфагией, артериальной гипертензией, судорожным синдромом, появлением ранних признаков старения и предобморочных состояний.
Для поражения брюшной части аорты характерно возникновение давящей, невыраженной боли в эпигастрии, запоров, диареи, вздутия живота, снижения веса, онемения ног, отека ног, дистрофических процессов (в т.ч. гангрены), дистонии икроножных мышц, нарушения эрекции у мужчин.
Неврологи Юсуповской больницы при наличии у пациентов признаков, которые могут свидетельствовать о склерозе аорты, в короткие сроки проводят комплексную диагностику с оценкой состояния сердца, сосудистой системы, липидограммы, коагуляционной активности, после чего назначают индивидуальную программу лечения.
Склероз аорты: лечение патологии
Консервативная терапия склероза аорты предполагает длительный (а чаще – пожизненный) прием препаратов, способствующих нормализации обмена жиров в организме: секвестров желчных кислот, статинов, фибратов, гиполипидемических средств, полиненасыщенных жирных кислот, желчегонных препаратов, витаминов и минеральных веществ (С, В2, В6, РР).
Хирургическое лечение склероза аорты представляет собой удаление атеросклеротической бляшки либо тромба с последующим протезированием аорты, благодаря чему происходит восстановление нормального кровотока. Проведение операции остро необходимо при инсульте, почечной недостаточности, ишемии почек, т.к. вследствие тромбоза артерии может развиться некроз и перитонит.
В Юсуповской больнице Москвы проводится диагностика и успешное лечение патологий сердечно-сосудистой системы, в т. ч. склероза аорты сердца.
Оборудование клиники позволяет врачу с высокой точностью выявить заболевание и назначить своевременное лечение, благодаря чему предупреждается развитие опасных осложнений.
Коррекция патологий проводится с использованием новейших технологий, для применения которых в Юсуповской больнице имеется вся необходимая современная аппаратура. Врач-координатор ответит на все интересующие вопросы по телефону.
Аневризма аорты, как распознать и вылечить
Аорта является главным кровеносным сосудом – однако она может потерять свою эластичность и на ней может образоваться разрыв. Но если проблему вовремя распознать, у пациентов будут хорошие шансы.
Дюссельдорф. Знаменитый писатель Томас Манн и физик Альберт Эйнштейн умерли, потому что их аорта постепенно вышла из строя. Врачи разных специализаций работают вместе, чтобы предотвратить такие смертельные случаи и сохранить здоровье аорты или – при необходимости – даже заменить ее.
Какую роль играет аорта в организме?
Аорта – жизненно важный кровеносный сосуд организма. Она берет начало в области сердца и проходит через грудную клетку и брюшную полость, а потом разделяется на два больших ответвления — подвздошные артерии.
У здорового человека аорта имеет диаметр два сантиметра. Она переносит кровь, обогащенную кислородом, из сердца и распределяет ее через свои ответвления по организму.
Десятилетиями аорте приходится ежедневно противодействовать изменениям (кровяного) давления.
Почему она оказывается под угрозой?
Если эта центральная линия жизни разрывается, человек истекает кровью в очень короткий срок.
«Только двадцать процентов пострадавших пациентов выживают поле такого события», — говорит профессор Кольвенбах, директор клиники сосудистой хирургии в Дюссельдорфе, который как раз и организовал с коллегами немецкий центр лечения аорты (DAD — Deutsche Aortenzentrum Düsseldorf).
Перед разрывом аорты развивается слабость стенки аорты. «Пусковые механизмы при этом могут быть разные. Так, есть некоторые пациенты, которые унаследовали слабую соединительную ткань, вследствие чего аорта может расшириться уже к 30-му году жизни», — объясняет Кольвенбах .
«Самыми частыми изменениями являются либо расширения, так называемые аневризмы, либо надрывы, называемые расслоениями аорты», — добавляет профессор д-р Ральф Кольфенбах.
Как возникают эти заболевания?
Когда аорта теряет свою эластичность, возникает выпячивание – аневризма. Ральф Кольфенбах: «В этом случае речь идет о некоем кровяном мешке, который может расти по причине соотношения давлений в области аорты». Если тонкая стенка аорты больше не выдерживает давления, она разрывается. Это может случиться внезапно при надрыве аорты – часто у пациентов с повышенным артериальным давлением.
Каким образом можно это распознать?
По словам профессора Кольфенбаха аневризмы можно диагностировать с помощью ультразвукового обследования. «Это не относится к изменениям аорты в грудной клетке. Здесь диагноз можно поставить только с помощью компьютерной томографии или магнитно-резонансной томографии», — утверждает специалист.
Часто аневризму обнаруживают случайно, когда брюшную полость обследуют по другим причинам – например, при проблемах с простатой. Аневризмы часто не вызывают дискомфорта в течение длительного времени. Однако они могут проявляться в виде болей в спине или животе.
В Великобритании и Скандинавии есть, по его словам, программы скрининга, которые предлагают проводить ультразвуковое обследование в группах риска – это предписание, которое может спасти жизнь и также предлагается немецкими врачами.
Существуют ли люди, которые подвергаются особенному риску?
Существуют факторы, которые, по словам профессора, сами по себе ведут к хроническим изменениям аорты, прежде всего никотин, повышенное давление и повышенное содержание липидов в крови. У мужчин, по его мнению, риск развития аневризмы в шесть раз выше – особенно среди множества курильщиков. По словам эксперта, заболевание также может встречаться многократно в пределах одной семьи.
Почему над этим совместно работают врачи многих специализаций?
Многие пациенты с ослабленной аортой в то же время имеют заболевания других сосудов или сердца.
Поэтому, по словам специалиста в области сосудов Кольфенбаха, для терапии важно междисциплинарное сотрудничество, которое привлекает экспертов других специализаций — например, кардиологии.
Кроме того, может потребоваться заменить пораженный участок аорты на протез или укрепить ее изнутри. В зависимости от того, сколько частей аорты поражено, иногда необходимо заменить всю артерию от ее начала в сердце до того места, где она разделяется на подвздошные артерии.
По словам Ральфа Кольфенбаха в специализированных центрах, дальнейшие разработки в медицине позволяют лечить пациентов с помощью имплантации так называемых стентов, изготовленных из специального пластика, в более чем 90 процентах случаев. Для этого необходимы сложные хирургические методы.
Таким образом, много хирургических вмешательств можно выполнить с помощью так называемой лапароскопической хирургии, то есть минимально инвазивной. Кольфенбах: «В отличие от открытой операции, она связана со значительно более низкой нагрузкой на пациента.
Исследования показывают, что риск смерти во время операции может быть значительно снижен этими методами». Центры имеют специальную инфраструктуру для этой операции, включая подготовку и поддерживающую терапию.
В дополнение к специалисту по сосудистой хирургии также задействованы специализированные анестезиологи, врачи интенсивной терапии, специалисты в кардиологии и кардиохирургии. Есть также врачи, которые консультируют пациентов с врожденными дефектами соединительной ткани.
Каковы перспективы для пациентов?
Если аневризма обнаружена своевременно, то, по мнению экспертов, перспектива хорошая, если пациенты будут регулярно обследоваться ультразвуком, чтобы узнать, растет ли выпячивание аорты, и возможно потребуется хирургическое вмешательство. После операции важно следить за тем, развиваются ли новые аневризмы. Важно для пациентов: они должны повергаться как можно меньшему числу рисков, больше не курить и хорошо отрегулировать кровяное давление.
Степени атеросклероза аорты
Атеросклероз аорты возникает в результате отложения холестерина внутри сосудов.
Это становится причиной образования тромбов, приводит к сужению и закупорке артерий.
Кровоснабжение кислородом сердца и мозга снижается, появляются разного рода патологии. Недуг развивается поэтапно, различают три степени атеросклероза аорты.
Аорта представляет собой самую крупную артерию организма, он нее кровь направляется к разным органам. Аорта состоит из трех отделов:
- восходящего, от которого идут коронарные артерии
- аортальной дуги – кровь идет к мозгу, направляется в область плеч, шеи
- нисходящий – направляет кровь к конечностям, брюшным и тазовым органам, грудной клетке.
Атеросклероз аорты проходит три степени:
1. Жировое липидное пятно 2. Липосклероз 3. Атерокальциноз
Если две первых степени подвергаются лечению, то последняя неизлечимая. Своевременно начатая терапия улучшает прогноз течения болезни.
Предпосылками развития заболевания являются частые стрессы, наличие сахарного диабета, пожилой возраст, курение, алкоголизм.
Стоит отметить, что атеросклерозу сосудов мужчины подвержены больше, чем женщины.
Первая степень — Жировое липидное пятно
Начало заболевание характеризуется проникновением липидов внутрь артерий. На сосудистых стенках образуются холестериновые пятна, которые постепенно разрастаются. Артерия утрачивает эластичность, становится хрупкой, внутренний просвет сужается.
Атеросклероз необходимо лечить незамедлительно, при появлении первых симптомов. Для этой болезни характерна повышенная утомляемость, одышка даже после незначительной нагрузки, конечности начинают неметь. Однако на ранней стадии заболевание может никак себя не проявлять.
Лечение начальной стадии включает:
- физические упражнения
- специальную диету
- рецепты народной медицины
Обычно, болезнь начинает давать о себе знать в возрасте 50 -60 лет. Начальная степень атеросклероза аорты диагностируется с помощью инструментальных методов. Врач назначает анализ крови: общий и биохимический, ультразвуковая диагностика или компьютерная томография поможет найти место расположения атеросклеротических бляшек.
Вторая степень — Липосклероз
На второй стадии вокруг жировых отложений разрастается соединительная ткань, начинают образовываться тромбы, развивается тромбоз. Головной мозг страдает от кислородного голодания.
На данном этапе необходима диагностика. Которая покажет уровень увеличения холестерина, липидов. Больной нуждается в медикаментозном лечении.
На данном этапе заболевание еще поддается лечению, бляшки могут раствориться, однако есть риск их отрыва и движения по сосудам.
На второй стадии симптомы становятся более отчетливыми, они зависят от пораженного отдела аорты:
- восходящая часть – в этом случае у больного появляются длительные боли в области грудной кости, они отдаются в правую руку или плечо, шею, верхнюю часть живота, боль может не проходить в течение нескольких дней, появляется шум в ушах, дискомфорт при физических нагрузках
- аортальная дуга – слабость, головокружение, потеря сознания, ослабление одной половины тела, нестабильность артериального давления, похолодание и онемение пальцев рук
- брюшная часть аорты – тошнота, онемение ног, снижение чувствительности, проблемы с мочеиспусканием, почечная недостаточность, болезни половой сферы.
Всегда страдает тот орган, к которому ведет пораженный сосуд. Но даже на второй стадии в некоторых случаях симптомы болезни могут ярко не проявляться.
Для установки диагноза потребуется комплексная диагностика.
Больному назначают препараты, снижающие уровень жиров в организме, каждый год пациент должен наблюдаться у врача, проходить обследование, сдавать анализы.
Третья степень — Атерокальциноз
Третья степень атеросклероза аорты характеризуется тяжелым течением. Бляшки уплотняются, в них накапливаются соли кальция. Больного поражает церебральный паралич, появляются необратимые нарушения сердечной функции. Данную стадию называют фиброзной, она неизлечима.
При риске развития осложнений: инсульта, инфаркта, аневризмы аорты, врач назначает хирургическое лечение. Возможно иссечение атеросклеротической бляшки, замена поврежденного участка артерии протезом, расширение суженного участка.
Больному придется на протяжении всей жизни принимать медикаментозные препараты, наблюдаться у специалиста.
Кроме основной терапии, которая направлена на замедление синтеза холестериновых молекул, снижение концентрации жиров, назначают лечение сопутствующих патологий.
Атеросклероз аорты – это опасное, быстропрогрессирующее заболевание, которое поражает кровеносную систему и весь организм, приводит к серьезным осложнениям.
Болезнь нужно своевременно диагностировать и незамедлительно лечить. В группе риска находятся пожилые и люди, имеющие вредные привычки.
Аневризма брюшной аорты
Содержание:
Аорта – самая большая артерия в организме человека, имеющая три отдела: восходящую часть, дугу аорты и нисходящую часть. Нисходящая часть аорты подразделяется на грудной и брюшной отделы.
Аневризма брюшной аорты – это патологическое расширение брюшного отдела аорты более 30 мм в диаметре.
Увеличение связано с ослаблением стенок аорты в результате возрастных изменений, генетической предрасположенности, травм, различных заболеваний, высокого артериального давления и т.д.
При сильном расширении артериальный сосуд разрывается, не выдерживая высокого давления в просвете. В результате происходит сильное внутреннее кровотечение с внезапной потерей сознания. Такое осложнение аневризмы аорты часто приводит к летальному исходу.
Ещё одним осложнением, связанным с аневризмой, является тромбоз. Тромбы (сгустки крови) образовываются в стенках аневризматического мешка.
Они опасны тем, что могут оторваться и застрять в мелких артериях, питающих важные органы.
Закупорка приводит к ишемии (недостаточность кровоснабжения), то есть орган перестаёт получать достаточное количество крови и питательных веществ, в результате чего его функция частично или полностью утрачивается.
Заболевание непредсказуемо: аневризма может существовать в организме человека всю жизнь, не вызывая беспокойств, может сопровождаться незначительными симптомами, а в ряде случаев — внезапно разорваться.
Симптомы и признаки аневризмы брюшной аорты
К некоторым признакам аневризмы брюшной аорты относят:
- частые болезненные ощущения в животе или в области поясницы;
- ощущение пульсации в животе;
- расстройства стула;
- симптомы хронической артериальной недостаточности нижних конечностей: усталость в ногах, онемение, бледность кожного покрова, боль в икрах, возникающая при ходьбе; в запущенной стадии болезнь проявляется непрекращающейся болью в нижних конечностях, а также появлением некрозов кожи и трофических язв.
При разрыве аневризмы боль в брюшной полости или пояснице становится невыносимой, человек теряет сознание. В таком случае необходима экстренная госпитализация.
Диагностика и лечение аневризмы
В группу риска входят пожилые пациенты с тяжёлой формой атеросклероза, курильщики с большим стажем курения, лица, страдающие гипертонией и сахарным диабетом. У молодых людей патология может развиться в результате травм живота и груди.
Запишитесь на консультацию к нашему врачу
Факторами риска возникновения аневризмы
- атеросклероз;
- гендерная принадлежность – мужчины чаще подвержены заболеванию;
- пожилой возраст;
- курение;
- наследственность;
- инфекционные воспалительные заболевания аорты (сифилис, туберкулез и др.
);
- виды спорта или работа, связанные с тяжёлой физической нагрузкой, например, подъём и перемещение тяжёлых грузов;
- травмы груди или живота.
Чтобы диагностировать аневризму брюшной аорты необходимо пройти ультразвуковое исследование (УЗИ) — дуплексное или триплексное сканирование брюшной аорты.
Как лечится аневризма?
До определённого размера аневризма лечится консервативно, т. е. безоперационно. Исключаются факторы риска – пациенту необходимо контролировать уровень сахара в крови, отказаться от курения, тяжёлого физического труда и т.д. Также назначается медикаментозная терапия — препараты из группы статинов.
Если аневризма брюшного отдела аорты продолжает расти и достигает 50-55 мм в диаметре, необходима операция, поскольку при таком диаметре велик риск разрыва.
Два основных способа оперативного лечения аневризмы аорты
- открытая операция по устранению аневризматического мешка и замена его на синтетический сосудистый протез;
- эндопротезирование аневризмы – изолирование аневризматического мешка от естественного просвета аорты с помощью специального металлического каркаса. Это менее травматичный, но более дорогостоящий вариант оперативного лечения.
Специалисты Медицинского центра «XXI век» рекомендуют не ждать развития болезни и при появлении подозрений на аневризму брюшной аорты обратиться за помощью.
В нашей клинике вы сможете пройти все необходимые диагностические исследования аорты и магистральных артерий (дуплексное/триплексное сканирование), пройти консультацию сосудистого хирурга и получить рекомендации по дальнейшему лечению.
Хирургическое лечение аневризм восходящего отдела аорты
Число операций, выполняемых на восходящем отделе аорты (ВоА), в Российской Федерации остается крайне малым как в абсолютном выражении, так и относительно других кардиохирургических вмешательств. В 2014 г.
суммарно выполнено 1595 операций, что на 13,3% больше, чем в предыдущем году, с одновременным уменьшением числа пациентов, оперированных на дуге и нисходящем отделе грудной аорты (ГА). Средняя послеоперационная летальность составила 8,59% (в 2013 г. — 8,38%).
Наиболее частыми методами хирургической коррекции были резекция с последующим протезированием аорты — 840 (52,7%) операций и надкоронарная резекция аорты — 397 (24,9%). При всех видах операций методом выбора коррекции нарушений функции аортального клапана (АК) было его протезирование.
Следует отметить, что среди всех видов хирургических приемов доля вмешательств на восходящей аорте (ВА) с одномоментной пластикой (ремоделированием, реимплантацией) АК в 2014 г. составила менее 6%. В 2,9% случаев операции выполнялись повторно, с общей летальностью 15,2% (в 2013 г. — 13,5%) [1].
Цель настоящего исследования — оценка результатов хирургического лечения больных с аневризмами восходящего отдела аорты (АВОА), в том числе клапансохраняющих операций протезирования корня аорты, и определение особенностей, оказывающих влияние на результаты лечения.
За период с 1 января 2006 г. по 1 октября 2015 г. в СЗ ФМИЦ им. В.А. Алмазова выполнено 570 операций при аневризмах и расслоениях ВоА. За указанный период при АВОА без ее расслоения выполнено 453 операции — 339 (74,8%) мужчин.
Из всей когорты пациентов 36,9% составили больные с бикуспидальным аортальным клапаном (БАК), 7,3% имели наследственные нарушения соединительной ткани, преимущественно синдром Марфана, но большинство пациентов (55,8%) относились к группе несиндромных несемейных заболеваний Г.А.
После ранее выполненных вмешательств на АК и ВА в связи со сформировавшимся аневризматическим расширением ВА повторно прооперированы 24 (5,3%) пациента.
Все пациенты проходили стандартное предоперационное обследование. Основной этап операции выполняли в условиях умеренной гипотермии (32—33 °С). Защита миокарда осуществлялась при помощи ретроградной прерывистой изотермической кровяной кардиоплегии либо антеградной селективной фармакохолодовой кардиоплегии раствором Кустодиол.
В качестве доступа во всех случаях использована продольная срединная стернотомия. После пережатия аорты и кардиоплегии выполняли продольную аортотомию, оценивали состояние створок АК, толщину стенок аорты в разных отделах. В зависимости от полученных данных принимали решение о виде хирургической коррекции.
При распространении аневризматического расширения на дугу аорты (ДА) выполняли протезирование нижней части ДА (hemiarch repair) либо всей ДА (изолированное протезирование ДА либо операция «хобот слона», в 1 случае — «замороженный хобот слона» с применением гибридного устройства E-Vita Open Plus).
В этом случае подключение аппарата искусственного кровообращения (АИК) осуществляли по схеме правая аксиллярная/бедренная артерия—правое предсердие. Хирургический этап на ДА проходил в условиях гипотермии 27—28 °С и антеградной моно- либо бигемисферальной церебральной перфузии под контролем непрерывной церебральной оксиметрии (Fore-Sight, CASMED).
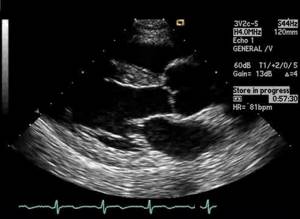
После реперфузии снятия зажима с аорты и согревания останавливали АИК и производили контрольную чреспищеводную эхокардиографию (ЧПЭхоКГ). Рану зашивали послойно наглухо с оставлением дренажей. При благоприятном течении ближайшего послеоперационного периода экстубацию пациента проводили через несколько часов после окончания операции.
При благоприятном течении на 7-е сутки после операции больного переводили в кардиологическое отделение, где он находился до выписки от 1 до 3 нед.
Результаты исследования обрабатывали с помощью компьютерной программы SPSS (Statistical Package for the Social Sciences)Statisticа 22.0 (IBM). Уровень значимости принимали p=0,05.
Количественные данные проверены на нормальность распределения с использованием критерия Шапиро—Уилка, учитывая размеры групп, а также на однородность дисперсии с использованием критерия Левина. Показатели, соответствующие параметрам нормального распределения, описывали в следующем виде: среднее арифметическое (М) ± стандартное отклонение (SD).
Показатели, не соответствовавшие параметрам нормального распределения (непараметрические), описывались в виде медианы (25—75-й процентиль). Сравнение выборок по показателям, соответствующим критериям нормального распределения и однородности выборки, производили методом однофакторного дисперсионного анализа (ANOVA).
Для сравнения групп по показателям, не соответствующим критериям нормального распределения и однородности дисперсии, использовали непараметрический критерий Спирмена при сравнении двух независимых выборок.
Наиболее часто выполняли операцию Бенталла—ДеБоно — 177 (39,1%), 2, 3 и 4-е места по частоте выполнения заняли сочетанная операция надкоронарного протезирования ВА и протезирования АК — 89 (19,6%), протезирование АК в сочетании с пластикой ВА — 67 (4,8%) и операция Дэвида I — 65 (14,3%). Реже выполняли операции надкоронарного протезирования ВА как изолированно, так и в сочетании с пластикой АК. В 6 (1,3%) случаях выполняли операцию «хобот слона», в том числе 1 операция «замороженный хобот слона» с применением гибридного устройства E-Vita Open Plus (рис. 1).
Рис. 1. Хирургические операции, использованные при лечении аневризм восходящей аорты (n=453). 1. Бенталл—ДеБоно — 177; 2. НП+ПАК — 89; 3. ПАК+плАо — 67; 4. Дэвид — 65; 5. Н.П. Ао — 33; 6. НП+плАК — 9; 7. плАо — 7; 8. «Хобот слона» — 6.
Наибольшей продолжительностью экстракорпорального кровообращения (ЭКК) и аноксии миокарда отличались операции Дэвида (рис. 2). В ближайшем послеоперационном периоде 13 (2,9%) больных перенесли рестернотомии в связи с кровотечением.
У 4 (0,9%) больных в течение пребывания в стационаре потребовалось выполнение фенестрации и дренирования полости перикарда.
У 11 (2,4%) больных интраоперационно и в раннем послеоперационном периоде наблюдались выраженные проявления сердечно-сосудистой недостаточности (ССН), в 6 случаях потребовавшие применения механической поддержки кровообращения (3 — внутриаортальный баллонный контрпульсатор, 3 — левожелудочковый обход).
Осложнения ближайшего послеоперационного периода отражены на рис. 3. Госпитальная летальность составила 2,6% (12 пациентов).
Причинами неблагоприятных исходов стали острая ССН (4 пациента), нарушения ритма сердца (2), острое нарушение мозгового кровообращения (ОНМК) (2), мультиорганная недостаточность (2) и неконтролируемое интраоперационное кровотечение (2) при исходном тяжелом инфекционном поражении структур ВоА. Строгой зависимости осложненного течения ближайшего послеоперационного периода от объема хирургической коррекции не выявлено.
Рис. 2. Параметры экстракорпорального кровообращения. Рис. 3. Осложнения ближайшего послеоперационного периода.
С 1 января 2006 г. по 1 октября 2015 г. нами были выполнены 68 операций клапансберегающего протезирования корня аорты по методике Дэвида I при аневризмах и расслоениях корня аорты. Из 47 пациентов 69% составили мужчины, 4 (5,9%) больных оперированы на фоне расслоения ВоА.
Госпитальная летальность составила 2 (2,9%) больных, причины: острая ССН — 1 и фатальное ОНМК — 1. В ближайшем послеоперационном периоде 7 пациентов перенесли рестернотомии по поводу кровотечений.
При оценке степени аортальной недостаточности (АН) в ближайшем послеоперационном периоде у подавляющего большинства больных наблюдалась регургитация 0—I степени; тяжелой АН выявлено не было.
В отдаленном послеоперационном периоде в группе больных, которым выполнялись операции Дэвида с применением протеза корня аорты Valsalva, АН более I степени выявлено не было; в группе пациентов с линейными протезами аорты в 76% случаев наблюдалась АН 0—I степени, в 16% — АН II степени и в 8% — выраженная А.Н.
Из последней подгруппы 3 пациента были реоперированы (выполнено протезирование АК), 2 находятся под усиленным наблюдением. При изучении предикторов рецидива АН в отдаленном послеоперационном периоде мы выделили такие факторы, как исходный диаметр фиброзного кольца (ФК) АК (коэффициент корреляции со степенью АН в отдаленном послеоперационном периоде r=0,55), положение точки коаптации створок АК (r=–0,778), а также наличие асимметричного пролапса створок АК (r=0,818).
- Методология хирургического лечения АВОА складывается из двух компонентов:
- — подлежащая коррекции область распространения аневризмы аорты;
- — степень вовлечения АК в патологический процесс.
- Следовательно, методологически правильным является выделение двух групп пациентов: 1-я — с аневризмами корня аорты с вовлечением в патологический процесс области синусов Вальсальвы и синотубулярного соединения, и 2-я — с аневризмами собственно ВоА.
Одной из актуальных проблем остается сохранение АК при протезировании корня и В.А. Методом выбора мы считаем операцию Дэвида I (реимплантацию АК), при которой достигается стабилизация корня аорты на всех уровнях: ФК АК, синусов Вальсальвы и синотубулярного соединения.
Недостатками являются техническая сложность вмешательства, отсутствие единой методики сохранения АК, вероятность резидуальной АН в ближайшем послеоперационном периоде и рецидива АН в отдаленные сроки. Относительно новым является применение при операциях Дэвида I протезов аорты с уже сформированными синусами — протезов Valsalva [4].
Декларируемыми положительными сторонами этого варианта в сравнении с классической операцией Дэвида является воссоздание тождественных физиологическим потоков крови в синусах Вальсальвы и движений полулунных створок, однако далеко не все исследователи признают необходимость подобной модернизации.
Мы выявили определенные закономерности в развитии АН в отдаленном послеоперационном периоде, однако отсутствие тяжелой АН у пациентов, которым выполнялись вмешательства с использованием протеза Valsalva, применяемым нами с 2010 г., говорят скорее о накоплении опыта операций, а не о преимуществе данного протеза по сравнению с линейными.
Главным и единственным условием для проведения реимплантации АК мы считаем состояние его створок. Фиброз, уплотнение и тем более кальциноз створок, с другой — истончение и фенестрации не позволяют сформировать «новый» клапан аорты с удовлетворительными характеристиками.
Операция Якуба технически проще, однако в связи с отсутствием стабилизации на уровне ФК АК существует риск рецидива А.Н. По той же причине выполнить ремоделирование АК невозможно при уже имеющемся расширении ФК А.К. Гибридные подходы (способы Дэвида III, Hopkins) технически гораздо более сложны и отдаленные результаты их изучены недостаточно.
В ряде центров при выборе тактики ведения пациентов с аневризмами и расширениями ВоА, особенно при наличии БАК, рутинно применяется генетическое тестирование для выявления мутаций, оказывающих влияние на структуру стенки ВА. К сожалению, как из-за недостаточной доказательной базы, так и по финансовым причинам этот подход до недавнего времени широко не применялся.
Другие клиники проводят исследования искажений гемодинамики в ВА, и на основании полученных результатов делают выбор в пользу того или иного метода лечения. Но это лишь единичные примеры мультидисциплинарного подхода к решению проблемы расширения ВоА. В рекомендациях по диагностике и лечению пациентов с заболеваниями аорты Европейского Кардиологического общества 2014 г.
есть указания о лечении пациентов с заболеваниями аорты с максимальной эффективностью в «аортальных клиниках» с привлечением мультидисциплинарной команды (aortic team) для того, чтобы гарантировать принятие оптимальных индивидуальных клинических решений. Не стоит забывать о наличии зависимости «число пациентов—результат», что весьма справедливо для патологии восходящей аорты [3].
В недавней статье T. Bradley и S. Bowdin [2] обсуждается вопрос принятия в качестве стандарта лечения в Канаде оказания помощи пациентам данного профиля в мультидисциплинарных клиниках заболеваний аорты.
К сожалению, в большинстве лечебных учреждений, оказывающих помощь пациентам с заболеваниями ВА, особенно в нашей стране, решение о выборе метода лечения принимается исключительно на основании размеров аорты и иногда без учета действующих международных рекомендаций.
Приблизительно к 2010—2011 гг. в нашем Центре сформировалась мультидисциплинарная команда из 10—12 человек, вовлеченная в диагностику и лечение пациентов с заболеваниями грудной аорты.
Aortic team включает рентгенологов, специализирующихся на мультиспиральной компьютерной томографии (МСКТ) и магнитно-резонансной томографии (МРТ) аорты, рентгенэндоваскулярных хирургов, проводящих инвазивную диагностику и полный спектр эндоваскулярных лечебных воздействий при патологии ГА и ее магистральных ветвей, кардиологов, в совершенстве владеющих методами функциональной диагностики, анестезиологов-перфузиологов, обеспечивающих ЭКК, интраоперационную защиту внутренних органов и головного мозга, хирургов, вовлеченных в процесс диагностики, отбора пациентов для хирургического лечения, предоперационной подготовки, ведения больных в ближайшем и отдаленном послеоперационных периодах, а также биологов-генетиков, изучающих фундаментальные механизмы формирования патологии аорты у различных групп пациентов. Введение подобного командного подхода позволило оптимизировать процесс диагностики, определения показаний и ведения пациента с заболеванием ГА на всех стадиях хирургического и эндоваскулярного лечения, получить хорошие, воспроизводимые результаты с перспективой их улучшения, а также получать фундаментальные данные о патогенезе аортопатий. Несмотря на очевидную необходимость раннего выявления расширения ВоА, что позволит предупредить возникновение острых осложнений, своевременная диагностика аневризм ГА и стратификация риска расслоения аорты у разных групп пациентов представляются непростыми задачами. На наш взгляд, именно изучение молекулярно-генетических основ патогенеза АВОА будет способствовать внедрению персонифицированного подхода в определении показаний к хирургическому лечению и разработке новых методов профилактической медицины.
Создание aortic team в отдельном центре позволило получить хороший воспроизводимый результат лечения больных с различной патологией восходящей аорты. Объем хирургической коррекции при патологии восходящей аорты сам по себе не является значимым фактором риска.
Дальнейшее совершенствование лечения данной патологии связано с научными разработками на стыке различных клинических и медико-биологических специальностей (хирургия, радиология, молекулярная биология и генетика). Актуальной задачей является создание единого регистра пациентов с заболеваниями аорты.
Выявление новых информативных биохимических маркеров может повлиять на сроки и объемы операции у пациентов данного профиля.
Конфликт интересов отсутствует.